刘凤森 平 玉 张 毅(郑州大学第一附属医院生物细胞治疗中心,郑州 450052)
相关研究表明,肿瘤相关成纤维细胞在肿瘤进展、化疗及免疫治疗耐药中发挥关键作用[1]。肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)作为肺癌基质中较关键的细胞成分,通过分泌多种细胞因子等方式参与细胞外基质重塑以及形成免疫抑制微环境,促进肺腺癌的发生发展及转移[2-4]。然而,由于肺癌患者中CAFs起源于不同的祖细胞,肿瘤中的CAFs亚群可能具有较大的异质性,导致其功能及作用机制具有一定的差异性。近期,LAMBRECHTS等[5]在自然医学杂志发表的文章揭示CAFs主要由7种不同的成纤维细胞亚群组成。单细胞测序分析显示其中6种成纤维细胞亚群表达特征性基因标志物。尽管目前多项研究表明成纤维细胞在化疗及免疫治疗耐药中发挥重要作用,然而肺腺癌中不同成纤维细胞亚群的临床意义及其对应的免疫学效应尚未明确[3]。本文结合单细胞测序得到6种成纤维细胞亚群的基因标志物,探究不同成纤维细胞亚群对应的临床意义及免疫学效应。本研究发现不同成纤维细胞亚群介导了不同的免疫效应及临床效应。因此,本研究很可能为肺腺癌的免疫治疗及精准治疗提供新的切入点[6]。
1.1 资料本研究纳入的肺腺癌患者样本均来自TCGA数据库(http://cancerge-nome.Nih.gov/),TCGA是目前最大的癌症基因信息数据库,是由美国国家癌症研究所(National Cancer Institute)和美国人类基因组研究所(National Human Genome Research Institute)共同监督的一个项目。本研究从TCGA数据库中提取了肺腺癌患者的数据信息,包括513例患者的遗传信息数据(mRNA)和对应的临床数据(性别、转移状态、肿瘤分期、吸烟史、生存状态、随访时间)。
1.2 方法
1.2.1 成纤维细胞亚群浸润分析结合LAMBRECHTS等[5]分析得到的6种成纤维细胞亚群的标志基因,利用R软件对TCGA中的肺腺癌患者的mRNAseq数据(TPM格式)进行了ssGSEA分析,由此得到了6种成纤维细胞在肿瘤中浸润的相对比例。ssGSEA在原理上与GSEA是类似的,是根据表达谱文件计算每个基因的排序值,再进行后续的统计分析。通过此方法,能够得到每个样本的某种细胞或者某种通路的相对活性值。
1.2.2 细胞浸润分析利用R软件对TCGA中的肺腺癌患者的mRNAseq数据(TPM格式)进行了xCell分析(64种细胞浸润分析),由此得到了64种免疫相关细胞在肿瘤中浸润的相对丰度。肺腺癌患者的细胞毒性因子评分和nTreg细胞浸润评分由ImmuneCellAI数据库(http://bioinfo.life.hust.edu.cn/web/ImmuCellAI/)下载得到。
1.2.3 预测免疫治疗应答的生物标志物通过肿瘤突变负荷(TMB)、新抗原数目、PD-L1蛋白表达水平、肿瘤免疫功能障碍与排斥(TIDE)评分和肿瘤干性评分评估不同成纤维细胞亚群的免疫学相关效应。肺腺癌患者的TMB和新抗原数据是从癌症免疫图谱数据库(https://tcia.at/home)中下载得到的。PD-L1蛋白质表达数据是从生物信息学门户网站(http://www.cbioportal.org)中下载得到的。TIDE评分已被证明在预测黑色素瘤和肺癌患者的免疫治疗反应方面优于已知的免疫治疗生物标志物。从TIDE网站(http://tide.dfci.harvard.edu)下载了肺腺癌患者的TIDE评分、T细胞功能障碍评分和T细胞排斥评分等。干性评分由干性基因集,经ssGSEA分析计算得到[7]。
1.3 统计学处理采用Kaplan-Meier曲线和Logrank检验,计算高危组和低危组成纤维细胞亚群的预后意义。根据“Survminer”R包的“surv_cutpoint”函数,将肺腺癌患者中的所有患者按最佳截断点分为高风险组和低风险组。Wilcoxon检验比较不同成纤维细胞亚群的组间差异。Spearman分析计算连续变量间的相关性。在所有统计方法中,P<0.05差异具有统计学意义。R软件版本3.6.1(https://www.r-project.org)用于上述数据分析。
2.1 患者临床病理资料的分布特征下载TCGA肺腺癌患者表达谱数据,得到513份样本数据。排除临床特征缺失值较多的患者后,纳入下游分析507例TCGA肺腺癌患者,其中T1(171例)、T2(268例)及M0(335例)期患者较多,多数患者有吸烟史,并大致呈正态分布。患者临床特征数据,见表1。

表1 TCGA肺腺癌患者的临床特征Tab.1 Clinical characteristics of TCGA patients with lung adenocarcinoma
2.2 不同成纤维细胞亚群的基因标志物及其在TCGA肺腺癌患者中的浸润分布特征成纤维细胞亚群的浸润分布特征,见图1。可以发现,不同患者的各成纤维细胞分布比例具有较大异质性,较多患者的整体成纤维细胞丰度相对较高,较少患者的整体成纤维细胞丰度相对较低。成纤维细胞亚群的标志基因,见表2。
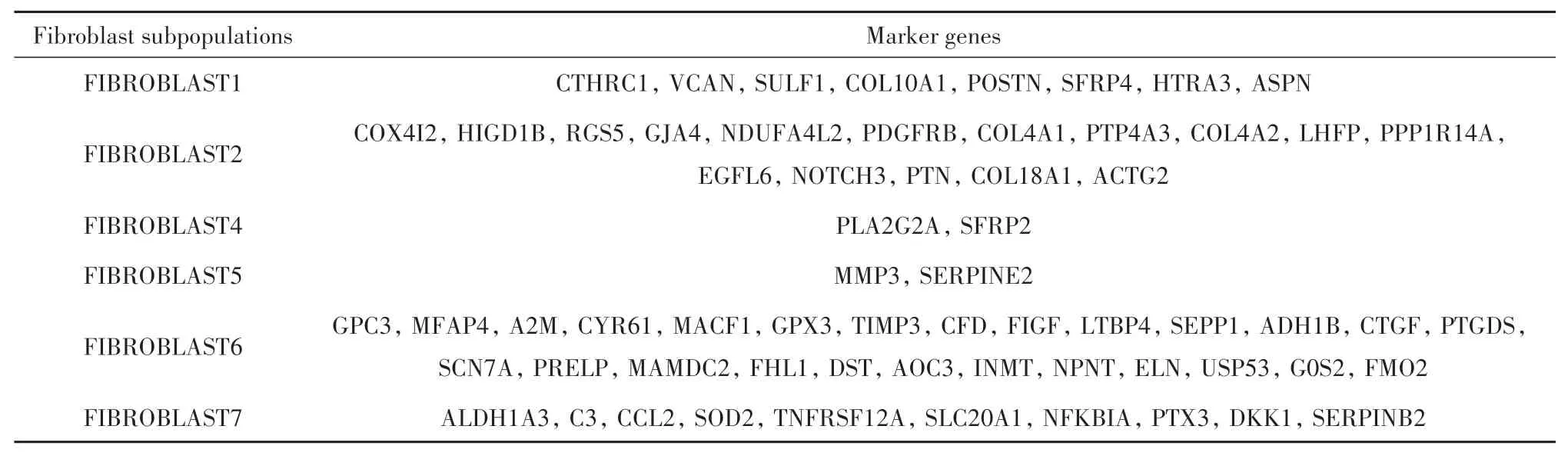
表2 成纤维细胞亚群的标志性基因Tab.2 Marker genes of fibroblast subpopulations

图1 6种成纤维细胞亚群在513例肺腺癌患者中的浸润分布Fig.1 Infiltration distribution of 6 kinds of fibroblast subpopulations in 513 patients with lung adenocarcinoma
2.3 成纤维细胞亚群和临床指标的相关性如图2,与男性患者相比,第5、6亚群成纤维细胞更多富集在女性患者(第5亚群P=0.004 6,第6亚群P=0.002 9),这提示不同的激素对成纤维细胞的浸润可能有一定的影响。此外,随着吸烟时间的延长,肿瘤内第6亚群的比例呈现逐渐下降的趋势(P<0.05)。第6亚群的浸润丰度在早期肿瘤中更高,这表明第6亚群可能抑制了肿瘤细胞的恶性进展(P<0.05)。另外,与肿瘤转移患者相比,第1、2亚群显著富集在未发生转移的患者(第1亚群P=0.029,第2亚群P=0.021),提示成纤维细胞可能在肿瘤微环境中发挥“栅栏”作用,抑制肿瘤细胞转移。

图2 成纤维细胞亚群和临床病理指标的相关性Fig.2 Correlation between fibroblast subpopulations and clinicopathological indicators
2.4 成纤维细胞亚群的预后价值 不同成纤维细胞亚群对患者的预后影响均不相同,其中第5、7亚群是患者的风险性预后因子(第5亚群P<0.001,第7亚群P<0.001),第6亚群是患者的保护性预后因子(第6亚群P=0.001 4),其他亚群无显著性差异,无预后意义,见图3。

图3 6种成纤维细胞亚群在513例肺腺癌患者中的生存曲线Fig.3 Survival curves of 6 kinds of fibroblast subpopulations in 513 patients with lung adenocarcinoma
2.5 第6亚群成纤维细胞和多种免疫相关细胞成分的相关性第6亚群成纤维细胞与免疫浸润评分(r=0.347)、淋巴内皮细胞评分(r=0.539)、内皮细胞评分(r=0.583)、细胞毒性因子评分(r=0.131)、中心记忆CD8+T细胞评分(r=0.104)均呈显著正相关(P<0.05),与自然调节性T细胞(r=-0.489)呈显著负相关(P<0.05),见图4。

图4 第6亚群成纤维细胞和免疫相关标志物的比较Fig.4 Comparison between sixth subgroup fibroblasts and immune-related markers
2.6 成纤维细胞亚群和免疫治疗反应标志物的相关性成纤维细胞亚群和抗原提呈及免疫检查点标志物呈显著正相关(P<0.05,图5A、B)。第1亚群和TMB及新抗原克隆数量呈正相关(P<0.05),而第2、6亚群和TMB及新抗原克隆数量呈负相关(P<0.05);
除第2、6亚群外,其他4群和PDL1蛋白表达均呈正相关(P<0.05,图5C)。这意味着成纤维细胞亚群在肿瘤微环境中的多种免疫过程中发挥重要作用。

图5 成纤维细胞亚群和免疫治疗反应标志物的相关性Fig.5 Correlation between fibroblast subpopulations and immunotherapy response markers
2.7 成纤维细胞亚群和免疫治疗耐药评分及肿瘤干性评分的相关性如图6,比较了TIDE系统评分及肿瘤干性评分和各个成纤维细胞亚群的相关性。除第6亚群外,其他5群均与免疫治疗耐药评分(P<0.01)和肿瘤干性评分(P<0.05)呈正相关,表明成纤维细胞亚群可能参与形成了免疫抑制微环境,以及参与维持肿瘤干性环境,而第6亚群可能抑制了肿瘤干性微环境的形成。

图6 成纤维细胞亚群和免疫治疗耐药评分及肿瘤干性评分的相关性Fig.6 Correlation of fibroblast subpopulations with immunotherapy resistance score and tumor stemness score
从TCGA数据库下载了肺腺癌患者的基因表达数据及临床病理数据,共纳入513例患者进行分析。在进行病理指标分析时,排除了6例含缺失值较多的患者进行下游分析。本课题组发现,肺腺癌中成纤维细胞亚群参与了肿瘤微环境中的多种免疫过程[8-9]。不同亚群的成纤维细胞介导了不同的免疫学效应和肿瘤学效应,具有不同的预后意义[10]。其中第6亚群(标志基因:FIGF、PDPN和PROX1等)与肿瘤的T分期及患者吸烟时长密切相关,具有良好的预后意义。进一步结合免疫相关细胞浸润分析,发现第6亚群成纤维细胞与肿瘤微环境中的脉管系统相关免疫评分(免疫浸润评分、淋巴内皮细胞评分、内皮细胞评分和中心记忆CD8T细胞评分)具有显著正相关,这意味着它可能促进并维持肿瘤免疫微环境。这促使探究成纤维细胞亚群是否参与维持了免疫治疗耐药和肿瘤干性[11]。第6亚群细胞未参与免疫治疗耐药,但是可能抑制了肿瘤干性微环境的形成,而其他亚群成纤维细胞均不同程度地介导了免疫治疗耐药并参与维持肿瘤干性微环境。
既往研究普遍认为成纤维细胞促进免疫抑制微环境的形成,介导肿瘤的发生发展甚至转移[12-13]。然而分析结果提示肺腺癌中成纤维细胞亚群有着不同的临床意义,如第6亚群的高浸润提示患者预后更好。鉴于第6亚群成纤维细胞的特殊临床意义,发现它特征性地表达FIGF基因,即血管内皮生长因子D。该生长因子常高表达于血管生成、淋巴管生成和内皮细胞生长阶段,促进淋巴管、血管内皮细胞的增殖和迁移,并对血管通透性及淋巴内皮细胞的维持有一定影响[14]。然而血管及淋巴管的生成对肿瘤免疫微环境的形成有重要作用[15]。进一步来说,肿瘤相关脉管系统的存在促进了免疫细胞的浸润,为化疗及免疫治疗的药物递送提供途径,这很可能是癌症治疗新的切入点[16]。结合第6亚群成纤维细胞和细胞毒CD8+T细胞的相关性结果,可以认为第6亚群成纤维细胞很可能促进并维持了瘤内脉管系统的功能,其为抗瘤免疫细胞及药物进入瘤内铺平道路。另外,第6亚群成纤维细胞和肿瘤干性评分的相关性结果提示,肿瘤脉管系统的活跃很可能抑制了肿瘤干性微环境的形成及维持。而对于其他亚群的成纤维细胞,类似于既往的研究,结果表明他们更多地参与了免疫治疗耐药及肿瘤干性的特征维持[17-18]。
总之,本研究强调了肺腺癌中成纤维细胞亚群的异质性组成,不同类型的成纤维细胞对患者的预后及免疫治疗效果的影响不同[2]。这突出了精准治疗的必要性:一方面,对于免疫抑制性的成纤维细胞,通过精准靶向消除,可以解除它们的免疫抑制作用;
另一方面,对于免疫促进性的成纤维细胞,积极采取多种方法提高其在肿瘤微环境中的权重,可以为抗瘤免疫细胞浸润及药物递送开辟途径。或许促使免疫抑制性的成纤维细胞向免疫促进性的成纤维细胞转化,是未来的肿瘤治疗方向。