王海强,饶 唱,曾 易,胡瑞雪,文兴建,励 娜,胡 光
(1.重庆理工大学 药物化学与分子药理学重庆市重点实验室, 重庆 400054;
2.重庆市中药研究院, 重庆 400065)
斑马鱼的免疫系统发育的比较完备,同时具备固有免疫与获得性免疫;
而其固有免疫系统可以区分自我和非自我rRNA[5],利用斑马鱼可以建立很多人类病原的感染模型及水生动物病原感染模型。斑马鱼免疫系统发育较早,在胚胎形成之后的1 d内,就可以检测到固有免疫反应。ELAVL1a是一种储存在早期胚胎中的膜磷壁酸(lipoteichoic acid,LTA)结合蛋白,它也是一种母体免疫因子,可以保护斑马鱼胚胎免受细菌感染[6]。肾脏作为斑马鱼的主要造血器官,相当于哺乳动物中的骨髓,其中含有T细胞、B细胞及树突状细胞(dendritic cells,DCs)等[7]。巨噬细胞专门识别调理病原体和非健康细胞(如凋亡和坏死细胞 )发出的信号。它们在固有免疫系统中发挥重要作用,可以直接来源于卵黄囊和胚胎肝脏,也可以来源于循环单核细胞。在炎症条件下,单核细胞在组织中转化为巨噬细胞。此外,巨噬细胞主要可分为:① 经典活化的巨噬细胞(M1),它们是宿主用来抵御病原体的介质,还具有抗肿瘤免疫作用[8]。② 替代活化的巨噬细胞(M2),具有抗炎和促进伤口愈合功能[9]。为了开发疫苗、治疗一些慢性炎症性疾病[10-11]和重新培养巨噬细胞以进行新的癌症治疗[12-13],人们有意追求免疫细胞的特异性和靶向性。细胞因子和趋化因子是免疫系统重要的组成部分。斑马鱼的相关因子已陆续得到分子鉴定,并显示出与其他鱼类的因子有很高的相似性。白细胞介素-6(interleukin-6,IL-6)是一种高度通用的细胞因子,不仅在免疫细胞中具有多效性作用,而且在其他细胞类型中也具有多效性作用;
此外,已经证明了IL-6还参与多种生理中枢神经系统过程,如神经元稳态,星形胶质细胞生成和神经元分化[14]。白细胞介素-8(interleukin-8,IL-8)是在炎症中最有效的嗜中性粒细胞化学诱导物之一,在其他几种功能中,负责引导中性粒细胞穿过组织基质到达损伤部位;
而斑马鱼可能拥有一个中性粒细胞亚群,其在炎症区域的募集独立于IL-8趋化因子[15]。干扰素在哺乳动物对病原体的抵抗中起重要作用,对于病原体的抵御与清除、控制肿瘤的滋生等免疫反应至关重要[16]。干扰素-γ(interferon-γ,IFN-γ)是一种T辅助细胞1型(Th1)细胞因子,在免疫和炎症反应的几乎所有阶段都发挥重要作用,IFN-γ可能参与炎症反应,并与哺乳动物的干扰素一样促进Th1免疫反应[17]。白细胞介素-10(interleukin-10,IL-10)由多种细胞产生,是一种高度多效性的细胞因子;
尽管它有时也显示出一些似乎相互矛盾的差异效应[18],但是它仍被证明可能与自身免疫性疾病和癌症的发病机制和发展相关。
近年来,很多学者的研究表明,植物多糖对鱼类的生长、抗菌抗病、免疫、抗氧化和降血糖血脂等方面有积极作用[19-21];
也在生物体和细胞的生命活动中发挥着重要作用,具有广泛的生物活性。例如:在饲料中添加膳食壳聚糖硒纳米颗粒(CTS-SeNP)可显著增强斑马鱼的免疫力和抗病性[22];
β-葡聚糖不仅能提高斑马鱼免疫能力,还能改善营养不良斑马鱼的运动性能和线粒体功能[23]。更有趣的是,现已证明β-葡聚糖具有跨代提高免疫力的作用,β-葡聚糖可以通过诱导溶菌酶分子从母体转移到卵子,并刺激其在卵母细胞中的内源性生产,从而提高后代的溶菌酶水平[24]。此外,多糖很有可能不会在肠道通过消化吸收的途径发挥功能,而是直接激活免疫信号通路,刺激免疫细胞的活化[25],或者通过改善肠道菌群结构,提高鱼类的免疫力[26]。
综上所述,斑马鱼在药物活性的研究中有着诸多的优点,包括,早期的胚胎为透明状态,便于连续观察胚胎发育的全过程等,适用于高通量筛选[27]。同时,作为脊椎动物,斑马鱼免疫系统发育的比较完备,同时具备固有免疫与获得性免疫;
加上野生型斑马鱼维护与实验成本比转基因型斑马鱼低了很多,使其更适合应用于较多数量药物的初筛过程。本文以经济的野生型斑马鱼为主要对象,总结了该模型在评价多糖的免疫促进作用的研究,并按照多糖的种类、多糖给药方式及其免疫活性评价方法、免疫活性评价用病原菌、研究涉及的信号通路等几方面,进行了分类说明。
2.1 多糖的种类
目前已有大量的天然多糖在科研和生活中被应用,例如常用于科研的甜菊糖、白芷多糖、榴莲果皮多糖、川芎多糖、枸杞多糖等。
Snega 等[28]以榴莲果皮为原料,提取多糖凝胶(PG),并用PG与枯草芽孢杆菌、丰年虾幼虫(artemia nauplii)分别组合后饲养斑马鱼,然后研究斑马鱼在弧菌浸泡激发(5 d)后诱导的免疫应答的效果。总红细胞计数、溶菌酶活性测试、体重和长度分析表明,与对照组相比,喂食PG的斑马鱼具有更高的免疫诱导活性、存活率和生长率。当检测免疫相关基因的表达时,研究显示与其他饲料相比,用含有PG的丰年虾喂养的鱼类的IL-1β、溶菌酶(lysozyme,Lyz)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、超氧化物歧化酶(superoxide dismutase,SOD)的基因表达显著上调(P<0.05)。
甜菊糖是一种具有药用功能的甜味剂,因其独特的生理功能而在食品和医药领域受到广泛关注[29]。SRP70-1是甜菊糖的主要有效成分,由甘露糖、葡萄糖、半乳糖和阿拉伯糖组成,摩尔比为1.15∶1.00∶3.77∶4.45,绝对分子量为7 698 Da。SRP70-1能显著促进细胞凋亡、吞噬并增加一氧化氮和细胞因子(包括IL-1β、IL-6和TNF-α)的释放,进一步的斑马鱼实验证实了SRP70-1的免疫增强作用[29]。
Sacks等[30]从白芷中获得水溶性多糖ADP80-2。ADP80-2由阿拉伯糖和微量葡萄糖组成,分子量为9950 g/mol。ADP80-2可以显著提高巨噬细胞的吞噬功能,促进一氧化氮(NO)的产生和细胞因子(IL-6、IL-1β和TNF-α )的分泌。在用ADP80-2处理后的斑马鱼模型中,蛋白质含量显著增加。这些生物学结果表明:ADP80-2具有免疫调节作用,有望被用于开发成为新的免疫调节剂。
张绍杰等[31]首次从川芎中分离到一种具有免疫作用的阿拉伯糖LCP70-2A。体外细胞实验表明,LCP70-2A可以通过增强吞噬功能和增强免疫调节因子(包括NO、TNF-α、IL-6和IL-1β)的分泌来激活巨噬细胞。此外,使用斑马鱼模型发现LCP70-2A可促进ROS和NO的释放,这表明LCP70-2A可进一步开发为免疫增强的候选补充剂。在该团队寻找生物活性多糖作为免疫调节剂的过程中[32],从藤黄皮中纯化并表征了一种阿拉伯呋喃多糖(GMP90-1),该多糖(绝对分子量:5 300 g/mol )由阿拉伯糖、半乳糖和鼠李糖组成。构象分析显示GMP90-1在氯化钠溶液中以刚性棒状结构存在。为了探索其作为免疫调节剂的潜力,进行了体外细胞筛选,发现GMP90-1可显著增强巨噬细胞的吞噬能力,并提高巨噬细胞的NO、IL-6、IL-1β和TNF-α的分泌水平。此外,斑马鱼体内实验证实了GMP90-1的细胞免疫调节活性,这表明具有免疫调节作用的GMP90-1可被认为是一种潜在的免疫调节剂,用于治疗免疫性疾病。
(1)投资估算。本工程总投资估算:2504.78万元,其中建筑工程投资1684.06万元,机电设备及安装工程投资2.90万元,金属结构设备及安装工程投资81.41万元,施工临时工程投资171.63万元,独立费用投资257.62万元,基本预备费219.76万元,建设征地移民补偿投资39.13万元,水土保持工程投资38.06万元,环境保护工程投资10.21万元。
β-葡聚糖(β-glucans)是从酵母细胞壁中发现的葡萄糖聚合物。在哺乳动物中,β-葡聚糖通过Toll样受体(toll-like receptors,TLR)TLR2/TLR6异二聚体[33]和小膜受体Dectin-1的识别激活固有免疫。体内注射β-葡聚糖可增强对寄生虫、细菌和病毒病原体的抵抗作用[34-35]。在饲料中添加β-葡聚糖喂养是向鱼类补充β-葡聚糖的最常见方式,该方式增加了固有免疫和获得性免疫应答的一些关键基因的转录水平[36]。然而,很少有文献研究β-葡聚糖喂养后,斑马鱼对病毒挑战的应答情况;
但有文献报道显示,用β-葡聚糖的饲养的太平洋鲱鱼对病毒性出血热病毒(VHSV)挑战表现出更强的抵抗力[37]。另一种葡聚糖应用方式,即单剂量注射,也被用于增强对疫苗的免疫反应,作为提高对病毒的抗病性的有效手段[38]。
胞外多糖(exopolysaccharides,EPS)是由红色微藻合成的一种有价值的代谢产物。它是一种无毒的天然药物,可作为免疫刺激剂使用。Risjani等[39]利用斑马鱼胚胎模型在体内进行了卟啉胞外多糖的毒性试验,随着EPS浓度的增加,总血细胞(THC)值、吞噬活性(PA)和呼吸爆发(RB)都有所增加。结果表明,卟啉菌胞外多糖是安全的,能够快速提高斑马鱼的免疫参数,并具有作为免疫刺激剂或免疫调节剂的能力,可作为弧菌病的预防剂。
枸杞(L.barbarum)果实或提取物是一种常见中药,用于调节身体免疫力和抗衰老,枸杞多糖(LBPs)一直以来被认为是其有效成分。Xia等[40]将斑马鱼胚胎连续暴露于不同浓度的LBPs中3 d,荧光吖啶橙和SA-β-gal染色结果表明,受精后24 h和72 h,细胞凋亡和衰老主要发生在头部。此外,在低剂量LBPs下,尤其是在3.0 mg/mL浓度下,观察到对复制性衰老的抵抗。与衰老相关的基因,如p53、p21和Bax的表达在LBPs治疗后降低,而Mdm2和TERT基因的表达在LBPs治疗后增加。结果表明,LBPs对细胞凋亡和衰老的影响可能是通过p53介导的途径实现的。LBPs通过抑制发育早期的细胞死亡和凋亡,降低p53、p21和Bax基因的表达水平,增加Mdm2和TERT基因的表达,缓解了斑马鱼的衰老[40]。
岩藻依聚糖来源于褐藻的富含岩藻糖的硫酸化多糖。来自不同藻类来源的岩藻依聚糖表现出独特的性质,例如抗炎、抗过敏、抗肿瘤或抗病毒作用[41],并因此被认为是功能性食品和治疗剂的预期成分[42]。Wakako等[43]分别通过浸泡(100和500 μg/mL,3 d)和喂食(3周)处理斑马鱼幼鱼和成年斑马鱼。褐藻糖胶处理仅轻微影响幼鱼体内微生物群的组成以及中性粒细胞和巨噬细胞的数量,用500 μg/mL褐藻糖胶处理的幼鱼中,促炎和抗炎细胞因子基因表达水平上调,喂食褐藻糖胶则明显改变了成年斑马鱼的肠道微生物组成[43]。揭示了在活生物体内岩藻依聚糖对未受攻击的斑马鱼的微生物群和免疫反应的调节作用,这强调了岩藻依聚糖在饮食-微生物群-宿主相互作用中发挥调节作用的潜力。采用不同种类的多糖提高斑马鱼免疫活性的研究如表1。
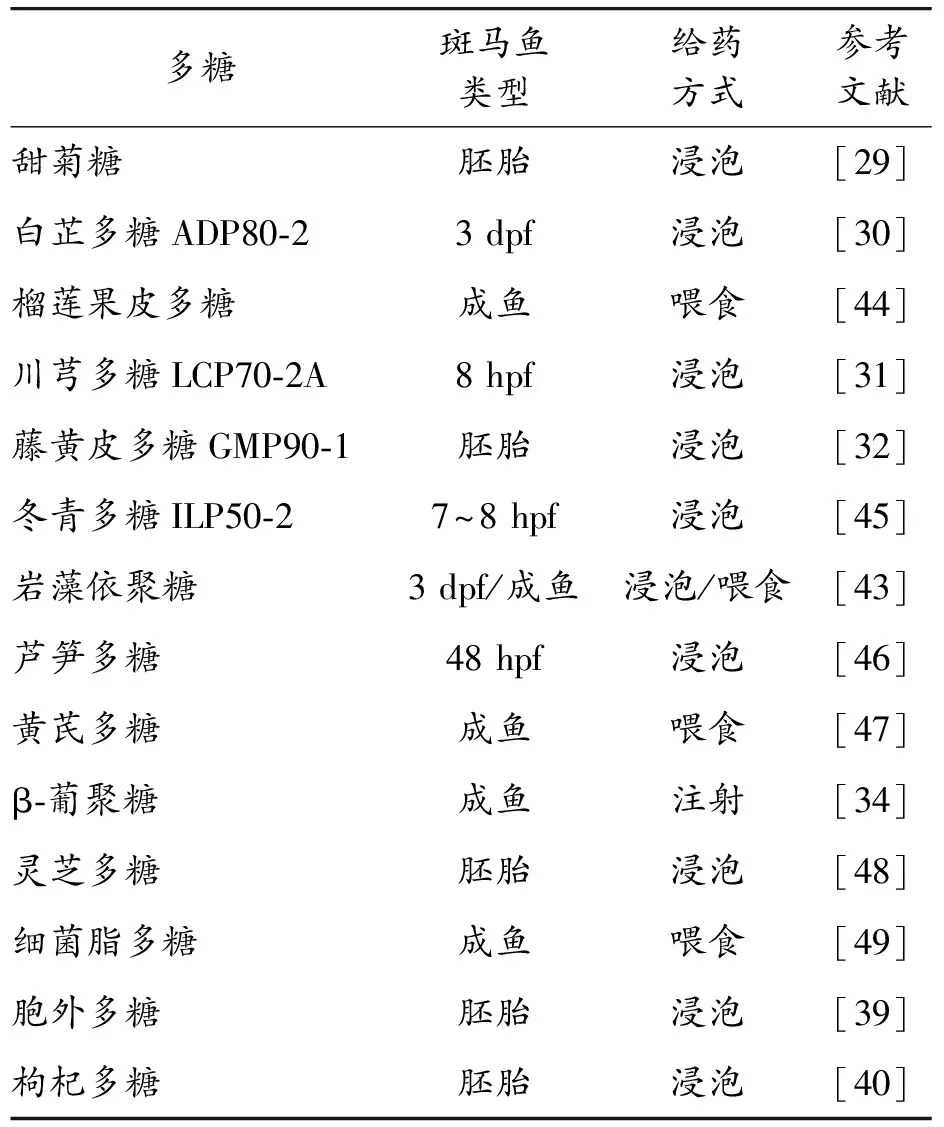
表1 采用不同种类的多糖提高斑马鱼免疫活性的研究列表
2.2 多糖给药方式及其免疫活性评价方法
斑马鱼的免疫给药方式大多数仍以注射为主,也有用喂食配制的多糖饲料,和用多糖溶液浸泡的方式进行的。但通过人工注射法进行免疫,不仅人工和时间成本较大,且容易引起鱼体强烈的应激反应,影响鱼体生长。故浸泡免疫是能普遍被接受的免疫接种方式[50]。Regla M等[38]研究了免疫刺激剂β-葡聚糖的抗病毒作用,在腹腔注射β-葡聚糖的斑马鱼中检测到与固有免疫反应有关的IL-1β、IL-6、IL-8、IL-10和TNF-α转录物的表达增加。Wang等[24]通过向斑马鱼投喂Miero鱼类食品或添加含1.25 g/kg β-1,3葡聚糖的鱼类食品,证明了β-葡聚糖可以提高几种鱼类的固有免疫和抗感染或抗致病菌的能力。Oyarbide等[51]为了评估β-葡聚糖对基因表达的影响,斑马鱼胚胎和幼鱼被浸泡在3种不同浓度的β-葡聚糖(50、100和150 μg/mL )中,且浸泡不同的暴露时间。当暴露时间较长且使用年龄较大的幼鱼时,观察到更强的基因诱导。β-葡聚糖最明显的作用是诱导TNF-α、MPO、TRF和LYZ基因的过度表达。此外,研究还发现在β-葡聚糖浸泡后,斑马鱼对鳗弧菌的抗性暂时增加。这表明不同给药方式都能提高斑马鱼的免疫水平,但浸泡接种方式被认为与病原感染类似,接近自然环境中鱼类免疫反应激活的方式,并能有效刺激鱼类的黏膜免疫应答,产生良好的免疫保护力[50]。在浸泡系统中使用黏液黏附纳米载体是给药和免疫调节剂的一种替代方法,因为纳米系统可以黏附在鱼的黏膜表面,对水的残留影响很小[52]。此外,浸泡在不同的纳米药物中也有很大区别:Crecente-Campo等[53]将斑马鱼暴露于4种纳米系统的5种不同浓度溶液中,证明了纳米范围内的微小变化能导致免疫细胞和生物分布特征的显著变化。是否能成功应用多糖治疗鱼类疾病,取决于能否确定每个物种的最有效剂量和给药时间[54]。
总之,与没有给药的斑马鱼相比,多糖给药后能显著提高斑马鱼的抗菌、抗病毒能力。此外,从文献的报道数量来看,通过细菌感染来评价多糖对斑马鱼免疫系统增强的文章数量少于未采用细菌未感染来评价的文章数量,大部分研究直接通过检测多糖给药后斑马鱼体内的免疫水平来给出结论。
目前,评价多糖促进免疫活性的指标的相应检测手段最主要为实时荧光定量PCR(quantitative real-time-PCR,qRT-PCR)、蛋白质印迹 (western blot,WB)、酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)等。同时,检测部位是以斑马鱼肠道组织为主,其次是肝脏、肾脏或斑马鱼全身。Snega等[44]使用RNA iso plus溶液均质组织(5条/缸),从中肠提取总RNA,并通过紫外可见分光光度计定量。使用PrimeScript TM II逆转录酶试剂盒将总RNA(1 μg)转化为cDNA。在Applied Biosystems Step One仪器中,使用SYBR GreenTM qPCR master mix测量基因表达。
Oyarbide等[51]通过RT-qPCR检测与免疫系统相关的某些选定基因的差异表达,表明受精后72 h的幼鱼处于评估所选基因表达的最佳发育阶段。Blanca 等[55]使用WB分析检测治疗后斑马鱼血浆中的重链蛋白A-琼脂糖珠和抗Ig M斑马鱼抗体。
2.3 免疫活性评价用病原菌
微生物的致病机理与宿主、病原和环境这3个要素息息相关。斑马鱼模型作为研究宿主与病原之间关系的模式动物在免疫学中得到了广泛应用,许多重要病原菌的致病机理通过斑马鱼模型也得到了深入的研究[56]。通过斑马鱼筛选有抗菌作用的饲料添加剂,可以预防这些细菌所引发的鱼类疾病[57]。所以使用斑马鱼建立细菌侵染模型,能很好地用于研究硬骨鱼类的抗病毒免疫应答[56-58]。嗜水气单胞菌是一种人畜共患病原体,对经典类抗生素具有高水平的耐药性。噬菌体或原噬菌体编码的裂解酶已显示出对抗病原菌的潜力。
Wang 等[59]从嗜水气单胞菌D4中鉴定出一种完整的原噬菌体(命名为phAhD4)。phAhD4在所有10个已发表的嗜水气单胞菌序列型(ST)251菌株中高度保守,并且是ST251菌株所特有的。通过原核表达获得由phAhD4编码的独特内溶素PlyD4。在此基础上,运用斑马鱼模型证明了PlyD4在体外对多种细菌具有杀菌活性,包括嗜水气单胞菌、维氏气单胞菌、副溶血性弧菌、铜绿假单胞菌等。斑马鱼在分枝杆菌引起的感染动物模型中赢得了一席之地。这种模型宿主特别有助于研究肉芽肿的作用,肉芽肿是分枝杆菌疾病的炎症病变特征。在固有免疫的背景下,这种光学透明的斑马鱼幼鱼为肉芽肿发展的初始阶段提供了一个窗口。
Varela 等[60]使用荧光染料和转基因标记物使固有免疫机制(如自噬和炎症体)如何在感染的巨噬细胞中被激活实现了实时可视化。影像学、遗传学和化学方法的结合表明,巨噬细胞和分枝杆菌之间的相互作用是组织播散和肉芽肿发展的主要驱动因素,而中性粒细胞在早期肉芽肿中具有保护作用。人类和斑马鱼之间保存的不同趋化因子信号轴已被证明可招募允许分枝杆菌生长的巨噬细胞,控制其杀微生物能力,推动其扩散和聚集,并介导肉芽肿血管生成。最后,用斑马鱼幼鱼来探索细胞的死亡过程,这也是肉芽肿扩张的关键因素。
除上述的几种病原菌外,斑马鱼也被应用于其他的病原菌研究中(表2)。采用绿色荧光蛋白GFP标记的鳗弧菌感染斑马鱼的模型阐明了肠道及皮肤在鳗弧菌感染鱼类中的作用[61],而该菌感染斑马鱼后体内免疫相关基因的转录水平变化也已经被研究[50,62]。铜绿假单胞菌(pseudomonas aeruginosa)的三型分泌系统在致病性中的作用以及斑马鱼体内的囊性纤维化跨膜传导调节蛋白(cystic fibrosis transmembrane conductance regulator,CFTR)对该菌的抵抗作用也得到了很好的阐述[63-64]。

表2 斑马鱼免疫活性评价用病原菌及感染方式列表
2.4 研究涉及的信号通路
宿主固有免疫反应是抵御入侵微生物的第一道防线。它的功能是在感染的第一阶段识别入侵的病原体并启动适当的免疫反应。病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和损伤相关分子模式(damage associated molecular patterns,DAMPs)被模式识别受体(pattern recognition receptors,PRRs)识别,其中Toll样受体(toll-like receptors,TLR)家族的研究最为广泛。髓样分化因子(myeloid differentiation factor 88,MyD88)是TLRs信号通路中的重要适配器蛋白,因为它被除TLR3以外的所有TLRs[73]所使用。其C端TIR结构域能够与TLRs相互作用,N端死亡结构域能够与白细胞介素-1受体相关激酶4(interleukin-1 receptorassociated kinase 4,IRAK4)相互作用,后者又招募白细胞介素-1受体相关激酶(interleukin-1 receptorassociated kinase 1,IRAK1)或白细胞介素-1 受体关联激酶2 (interleukin-1 receptorassociated kinase 2,IRAK2)形成“Myddosome”信号传导复合物,激活核因子κB(nuclear factor kappa-B,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号传导[74]。Myddosome还在白细胞介素-1(interleukin-1,IL-1),IL-18和IL-33受体的下游起作用,并且它与IFN-γ受体信号传导有关,增加了其在炎症和宿主防御中的核心作用。TLRs是一类重要的PRRs,可识别微生物和危险信号。它们在配体结合时的下游信号对于固有免疫反应的启动至关重要。在人类和哺乳动物模型中,MYD 88以其在IL-1受体(IL-1R)和TLRs信号传导中作为适配器分子的核心作用而闻名。Van der Vaart M[75]描述了一个带有截短的MyD 88的斑马鱼系,作为TLRs信号组件的第一个斑马鱼突变体,证明免疫受损的突变体在标准饲养条件下的存活率较低,并且更容易受到急性细菌病原体迟缓爱德华氏菌和鼠伤寒沙门氏菌的挑战,基因微阵列分析和定量PCR分析显示,固有免疫(包括NF-κB和AP-1)和促炎细胞因子IL-1β的转录因子的基因表达在这些细菌感染期间依赖于MyD 88信号传导。
NOD样受体(NOD-like receptor,NLR)是一大类细胞内PRRs,具有核苷酸结合域(nucleotide binding domain,NBD)和富含亮氨酸的重复(leucine rich repeat,LRR)区域的特征性排列。NLR最突出的功能是识别细胞内病原体相关分子模式(PAMPs)[76]。系统发育分析揭示了NLR家族中的3个不同的亚家族:NOD(NOD1-2,NOD3/NLRC3,NOD4/NLRC5,NOD5/NLRX1,CIITA),NLRP(NLRP1-14,也称为NALPs)和由IPAF(NLRC4)和NAIP组成的IPAF亚家族[77]。其中,NOD1是第一个被表征的NLR成员[78]。在哺乳动物中,NOD1可感知D-谷氨酰-内消旋二氨基庚酸(DAP),这是在所有革兰氏阴性细菌和少数革兰氏阳性细菌中发现的细菌肽聚糖(peptidoglycan,PGN)片段[79]。配体结合后,NOD1通过CARD-CARD结构域相互作用与受体相互作用蛋白2(RICK/RIP2)相互作用,从而触发NF-κB和MAPK途径的激活[80]。这些信号级联反应有效地上调促炎细胞因子和抗菌分子的产生,构成固有免疫反应。
CD44是一种跨膜黏附分子,是透明质酸的主要受体。除了介导T细胞外渗的关键作用[81],调节效应器T细胞反应[82]和T细胞发育,CD44还激活PI3K-Akt途径,该途径与包括白血病细胞在内的各种细胞类型的细胞存活有关[83]。有研究已经确定了CD44,TLRs和PI3K-Akt通路在病理条件下的相互作用[84-85]。然而,NOD1、CD44和PI3K-Akt途径之间的功能相关性是否存在于免疫系统中,特别是在早期本体发生期间,目前尚不清楚。
PRRs对于宿主防御和组织稳态对抗感染病原体至关重要。PRRs在不同物种间具有高度保守性,表明它们在基本生物过程中的关键作用。尽管对NOD1受体在固有免疫和获得性免疫反应的研究已经比较充分,但对NOD1在胚胎和幼鱼阶段的作用仍然知之甚少。Hu等[86]报道了NOD1对于PI3K-Akt途径的调节和斑马鱼幼鱼存活是必要的。转录组分析表明,NOD1-/-斑马鱼中主要在参与新陈代谢和免疫系统过程的通路中发生显著富集。生化分析表明,CD44a的表达需要NOD1,而CD44a又在幼鱼发育过程中激活PI3K-Akt途径。相反,在NOD1缺陷斑马鱼中CD44a的过度表达恢复了PI3K-Akt途径的调节并改善了幼鱼的存活率。总的来说,Hu等的研究表明,NOD1通过CD44a介导的PI3K-Akt信号传导的激活,在幼鱼存活中起着以前未被发现的保护作用。
概述了斑马鱼模型在多糖免疫中的应用和独特优势,介绍了采用斑马鱼模型进行多糖免疫相关研究的进展。免疫治疗是近年来的研究热点话题,尤其是在PD-1、PDL-1调节免疫系统抗癌方面更是不断取得重大突破[87-88]。多糖的种类繁多,研究前景广阔,在免疫方面具有明显的促进免疫活性和抗菌作用;
然而许多相关的机制尚不清楚,有待于进一步研究与开发。与传统的经典体内、外模型相比,斑马鱼免疫活性筛选模型兼具体内和体外的优势:既有体外的操作相对简单、经济、快速,适合高通量筛选的特点;
又同时属于整体动物模型,具备相对完整的代谢系统,幼鱼整体透明便于观察,所得到的数据比单纯的体外筛选结果更加可信,在今后的药物筛选研究中依旧有良好的前景。