陈頔 殷剑 田晓鑫 侯世芳 赵明 张华 杨莉萍
重症肌无力(myasthenia gravis,MG)是一种由乙酰胆碱受体抗体介导、细胞免疫依赖、补体参与,累及神经肌肉接头突触后膜,引起神经肌肉接头传递障碍,出现骨骼肌收缩无力的获得性自身免疫性疾病[1]。其典型临床表现为某些特定的横纹肌群肌无力呈斑片状分布,表现为波动性和易疲劳性;
肌无力症状晨轻暮重,持续活动后加重,休息后缓解、好转[1]。在MG的治疗中,免疫抑制剂为主要的长期治疗药物。他克莫司(tacrolimus,FK506)为一种新型的强效免疫抑制剂,可有效地治疗MG。该药个体差异大、治疗窗窄,需要依据血药浓度监测调整给药剂量,故FK506血药浓度成为MG治疗早期的重要实验室指标。FK506主要经过CYP3A4/5代谢,研究发现CYP3A5基因多态性与FK506血药浓度具有一定相关性,其中CYP3A5*3等位基因是目前研究广泛、证据级别较高的突变位点,也是中国人群患者中的突变频率较高的位点,可根据此基因多态性预测给药剂量[2-3]。本研究通过评价MG患者血药浓度的达标情况、治疗效果、住院时间、治疗费用等指标,初步探讨CYP3A5基因检测对MG患者FK506个体化治疗中的指导作用,为患者的精准药物治疗提供参考依据。
1.1 研究对象选择2013年1月至2019年12月北京医院神经内科使用FK506的MG患者为研究对象。纳入标准:(1)根据《中国重症肌无力诊断和治疗指南2015》[1]MG诊断明确,具体为:在具有MG典型临床特征的基础上,具备药理学特征(新斯的明试验阳性)和(或)神经电生理学特征(低频重复神经电刺激检查低频刺激波幅递减10%以上;
单纤维肌电图测定的“颤抖”增宽、伴或不伴有阻滞)。根据改良Osserman分型,纳入所有MG分型患者,包括:Ⅰ型、ⅡA型、ⅡB型、Ⅲ型、Ⅳ型、Ⅴ型。(2)连续应用FK506用药治疗2周以上。(3)患者住院期间进行FK506血药浓度监测。排除标准:(1)死亡病例;
(2)资料不完整。
1.2 方法
1.2.1资料采集:从电子病历系统采集患者住院期间的以下资料:(1)一般资料:性别、年龄、身高、体重等;
(2)FK506血药浓度;
(3)CYP3A5 基因型;
(4)MG改良Osserman分型及临床绝对评分[4];
(5)住院时间、药品品种数、治疗费用、药品费用、药占比等。
1.2.2患者分组及给药方案:将纳入患者按照是否进行CYP3A5基因多态性指导个体化治疗分为基因指导治疗组和常规治疗组。基因指导治疗组根据CYP3A5基因型制定给药方案,结合FK506血药浓度结果调整给药剂量:快代谢型(CYP3A5*1*1型)或中间代谢型(CYP3A5*1*3型)起始剂量为2 mg/d,每3 d增加1 mg,增至3 mg/d或4 mg/d时,维持7 d左右达到稳态,首次测定FK506血药浓度;
慢代谢型(CYP3A5*3*3型)起始剂量为1 mg/d,每3 d增加1 mg,增至2 mg/d时维持7 d左右达到稳态,首次测定FK506血药浓度。常规治疗组患者按照MG患者FK506传统的逐渐增量法给药:FK506 起始剂量为1 mg/d,每3 d增加1 mg至3 mg/d,维持7 d左右达到稳态,首次进行FK506血药浓度监测,根据结果调整剂量。
1.2.3血药浓度监测:对于MG治疗,目前推荐的安全有效浓度范围(治疗窗)为5~10 ng/mL[5]。在FK506剂量增加阶段,通常当预计维持剂量使用1周左右进行首次血药浓度测定。此后,根据血药浓度和临床情况,判断是否需要调整剂量。若无需调整,住院期间通常每周测定1次,以监测血药浓度变化。若需要进行剂量调整,则在每次调整后约3~7 d测定,以评估血药浓度是否达标。另外,若患者出现病情或治疗变化,如病情加重、出现可疑不良反应、加用其他可能影响FK506代谢的药物以及其他临床认为需要测定血药浓度的情况,则根据临床需要进行血药浓度测定。本研究采用化学发光微粒子免疫分析法(雅培,Architect i1000SR)测定FK506血药浓度。检测当日于服药前抽取静脉血2 mL(EDTA抗凝),取其中200 μL全血加入200 μL FK506全血沉淀剂,充分混匀后以13000 r/min(离心半径50 mm)离心4 min,取上清液置于FK506预处理管中,上机检测。
1.2.4CYP3A5基因检测:基因指导治疗组患者使用EDTA抗凝管取静脉血2 mL,200 μL全血加入1000 μL NH4Cl,混匀后室温放置5 min,以3000 r/min(离心半径50 mm)离心5 min,弃上清。加入150 μL核酸纯化试剂,反复吹打混匀,室温放置20~30 min,缓慢颠倒混匀2次。将经上述处理后的白细胞保存液1.0 μL,加入测序反应通用试剂盒中,上机检测。采用荧光染色原位杂交检测方法及配套的实时荧光定量PCR仪、微测序基因分析系统,检测CYP3A5*3,6986 A>G基因位点。
1.2.5评价指标及分析:(1)实验室疗效评价:比较基因指导治疗组和常规治疗组患者住院期间FK506稳态全血谷浓度值、达标率(达到治疗窗例次/未达治疗窗例次×100%)。(2)临床疗效评价:肌无力严重程度判定采用临床绝对评分法[4],疗效评价采用我国的临床相对评分法[5]。临床相对评分=(治疗前绝对评分—治疗后绝对评分)/治疗前绝对评分×100%。(3)经济指标评价:两组患者的住院时间、次均住院费用(住院期间费用总和)、次均药品费用(住院期间药品费用总和)、日均住院费用(次均住院费用/住院时间)、日均药品费用(次均药品费用/住院时间)、药占比(次均药品费用/次均住院费用×100%)等评价指标。这些指标均由医院HIS系统自动计算获得。
1.3 统计学处理应用SPSS19.0软件进行分析。对计量资料数据进行正态性和方差齐性检验(F检验),符合正态分布者计量资料以均 数±标准差表示,两组间比较采用独立样本t检验。计数资料采用例数(%)表示,两组间比较采用卡方检验。以P<0.05认为差异有统计学意义。
2.1 患者一般情况共纳入546例MG患者,其中基因指导治疗组363例、常规治疗组183例。两组患者的性别、年龄、身高、体重差异无统计学意义(P>0.05),具体见表1。

表1 两组MG患者一般资料及部分临床资料比较
2.2 血药浓度达标情况546例MG患者,共进行921例次FK506血药浓度监测,其中基因指导治疗组患者681例次、常规治疗组240例次。结果显示,基因指导治疗组和常规治疗组患者FK506的平均血药浓度分别为(6.43±4.76)ng/mL和(6.09±5.56)ng/mL,两组间差异无统计学意义(P>0.05);
两组浓度达标率分别为38.18%和29.58%,基因指导治疗组达标率高于常规治疗组(P<0.05);
在未达标的浓度中,基因指导治疗组与常规治疗组小于5 ng/mL者分别为305例次(44.79%)和132例次(55.00%),大于10 ng/mL者分别为116例次(17.03%)和37例次(15.42%),两组间差异有统计学意义(P<0.05)。两组患者的血药浓度结果及分布情况见表2。

表2 两组MG患者FK506血药浓度监测结果比较
2.3 两组患者临床疗效评价两组患者治疗前、治疗后临床绝对评分无统计学差异(P>0.05),临床相对评分亦无统计学差异(P>0.05),这表明两组患者的疾病严重程度及治疗效果基本一致。具体见表3。
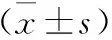
表3 两组MG患者的临床疗效评价比较
2.4 两组患者住院时间和医疗费用比较与常规治疗组比较,基因指导治疗组平均住院日缩短、住院期间使用药品品种数减少〔均P<0.05〕。基因指导治疗组患者次均费用、日均治疗费用、日均药品费用、药占比低于常规治疗组,次均药品费用高于常规治疗组,但差异均无统计学意义(P>0.05)。具体见表4。
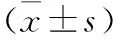
表4 两组MG患者住院情况与医疗费用比较
FK506为一种强效免疫抑制剂,对MG有较好的疗效。由于FK506的治疗窗窄、个体差异大、需要根据血药浓度调整用药剂量,并且患者遗传特征可影响其血药浓度。有研究证实在CYP3A5基因型指导组中,肾移植患者FK506浓度达标率更高,且给药时间更短,剂量调整次数更少[6]。研究表明,MG患者的基因型CYP3A5*1*1、CYP3A5*1*3及CYP3A5*3*3分别占3.0%、41.7%及55.3%[7];
若MG患者CYP3A5基因为快代谢型,其FK506适宜剂量为4~5 mg/d[8],若为慢代谢型,通常FK506剂量2 mg/d时血药浓度即可达标[9]。据此,本研究基于患者CYP3A5不同基因型设定了基因指导治疗组FK506的给药方案,即快代谢型(CYP3A5*1*1型)或中间代谢型(CYP3A5*1*3型)起始剂量为2 mg/d,增至3 mg/d或4 mg/d时,测定FK506血药浓度;
慢代谢型(CYP3A5*3*3型)起始剂量为1 mg/d,增至2 mg/d时首次测定FK506血药浓度。分析针对不同CYP3A5基因型设定给药剂量对MG患者疗效及医疗费用的影响。
本研究结果显示,在血药浓度方面,基因指导治疗组患者血药浓度达标率高于常规治疗组,表明根据CYP3A5基因多态性制定给药方法可提高FK506血药浓度的达标率。在临床疗效方面,治疗后基因指导治疗组临床相对评分高于常规治疗组,但差异无统计学意义。由此看出,按照不同基因型设定给药剂量提高了患者血药浓度的达标率,但出院时两组患者临床疗效未见明显差异,这可能与以下原因有关:首先,目前通常在临床实际工作中,是将病情出现好转或基本稳定作为出院标准。本研究是基于临床真实数据开展的研究,将出院时的疗效作为评价指标。因此两组患者出院时病情改善情况应无明显差异。其次,FK506血药浓度达标仅是临床起效的条件之一,但血药浓度达标并不一定出现临床疗效,临床疗效可能存在一定的滞后性。同时,患者的血药浓度与临床疗效的相关性也可能受到合并用药等其他因素的影响,量效关系可能存在个体差异,血药浓度达标率与临床疗效在实际情况并不一定完全匹配。
但是,本研究在疗效评价方面也存在一些不足之处:首先,本研究观察期较短。在指南中指出[10],该药一般2周左右起效,疗效呈剂量依赖性,且通常需要在血药浓度达标后表现出较好的疗效。由于FK506通常在给药后3 d至1周达到稳态后方可测定血药浓度,再加上治疗初期剂量增加的时间,从开始用药到表现出较好的疗效往往至少需要3~4周。本研究仅观察了患者住院期间的治疗情况,基因指导治疗组平均住院时间26.0 d,常规治疗组31.7 d。在此期间,患者通常可能是药物刚刚起效,尚未达到最佳的治疗效果。其次,本研究仅比较了出院时患者的疗效,未对同一时间点两组患者的疗效进行比较。因此,关于依据基因型制定给药方案对临床疗效的影响,本研究只是初步探索,今后可开展更严格的随机对照研究,并对患者进行较长时间的随访。
在患者住院时间与费用方面,本研究结果显示,基因指导治疗组平均住院日为21.0 d,远低于常规治疗组(31.7 d),减少约18%。这主要是由于根据基因型预测患者适宜的给药剂量可避免反复多次FK506的剂量调整,从而减少了住院时间,进而可能使患者的医源性并发症也减少,故患者住院期间的药品品种数也相应减少。对于患者的次均住院和次均药品费用,理论上也应随着患者的平均住院日的减少而降低。但本研究中基因指导治疗组的其余经济学指标未见明显优势,其原因可能为,医疗改革情况下,治疗费用与药品价格的波动、患者合并用药的差异及临床治疗的复杂性等因素有关,而本研究未对这些指标的变化情况进行校正,这同时也是研究的局限性。
综上,本研究中,针对采用基因指导干预和传统给药方式FK506治疗的MG患者,比较分析其血药浓度达标率、住院时间、治疗费用等指标,初步证实了在CYP3A5基因指导下的个体化给药,有利于提高FK506血药浓度达标率并缩短住院时间,但未明显改善患者住院期间的临床疗效。由于MG患者免疫抑制治疗是一个长期的过程,药物治疗的有效性及安全性评价需要进行长时间的观察。因此,今后仍需要开展更多高质量、大样本、长周期的临床研究,以进一步明确基因导向的个体化给药在临床治疗中的作用。
猜你喜欢 血药浓度达标率住院 腹透相关性腹膜炎患者万古霉素腹腔内给药后的血药浓度影响因素分析中南药学(2022年2期)2022-11-14情感障碍患者的丙戊酸钠血药浓度在临床中的作用价值分析四川生理科学杂志(2022年9期)2022-10-10真实世界中联用丙戊酸盐对奥氮平血药浓度的影响中国现代医生(2022年6期)2022-04-23住院病案首页ICD编码质量在DRG付费中的应用中国典型病例大全(2022年7期)2022-04-22烟草可降低血中药物浓度心理与健康(2020年3期)2020-03-25四川脱贫攻坚半年“成绩单”出炉四川党的建设(2019年15期)2019-09-20卷烟企业调入烟叶的等级质量探讨智富时代(2017年7期)2017-09-05卷烟企业调入烟叶的等级质量探讨智富时代(2017年7期)2017-09-05Alzheimer’s patient’s heart doesn’t forget a mother’s day tradition第二课堂(课外活动版)(2015年5期)2015-10-212014年乘用车企平均油耗公布世界汽车(2015年5期)2015-09-10