张 昕 刘丹阳 赵 蕊
沈阳市第六人民医院 (辽宁 沈阳, 110006)
消化道食管胃底静脉曲张破裂出血是肝硬化严重的并发症之一,发病率高达55.6%[1],6周内病死率高达20%[2]。肝性脑病(HE)是肝硬化严重的并发症之一,肝硬化患者伴HE的发病率为30%~45%[3]。肝硬化患者同时合并消化道出血及HE,大大增加了患者的死亡率,为研究肝硬化消化道出血伴HE的危险因素,本文对沈阳市第六人民医院收治的99例肝硬化消化道出血患者进行了回顾性分析。
1.1 一般资料 回顾收集2020年1月至2020年8月沈阳市第六人民医院内科、介入科、ICU收治的肝硬化伴消化道出血患者99例,男66例,女33例,年龄31~90岁,平均(58.31±10.86)岁。按肝硬化原因分类,酒精性肝硬化39例,乙型肝炎肝硬化27例,丙型肝炎肝硬化5例,药物性肝炎肝硬化3例,自身免疫性肝病肝硬化12例,隐源性肝硬化12例,遗传代谢性肝硬化1例。根据有无合并HE分为伴有HE的观察组和未发生HE的对照组,其中观察组34例,对照组65例。
1.2 纳入标准 ①既往有明确的肝硬化病史,或有影像学检查支持肝硬化诊断;
②以呕血或黑便为首发症状入院的;
③伴有显性HE:有临床可识别的神经精神症状及体征,血氨升高,并能排除其他导致神经精神异常的疾病,如代谢性脑病、中毒性脑病、神经系统疾病、精神疾病等。
1.3 排除标准 ①伴有严重的心、肺、肾、血液等基础疾病的患者;
②严重的电解质紊乱。
1.4 观察指标 ①一般资料:两组患者的性别、年龄、体重指数(BMI)。②实验室检查指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(γ-GGT)、总胆红素(TBil)、总蛋白(TP)、白蛋白(Alb)、胆碱酯酶(CHE)、白细胞计数(WBC)、血小板(PLT)、血红蛋白(Hb)、凝血酶原时间(PT)、凝血酶原活动度(PTA)、肌酐、尿素氮;
住院期间血红蛋白最低值(Hbmin)。③腹部超声:是否伴有腹水。④临床情况:肝硬化病因诊断、治疗方式(1=药物保守治疗、2=药物治疗基础上行TIPS、3=药物治疗基础上行内镜下止血)、死亡情况。

2.1 两组患者一般资料情况 观察组患者34例,其中男26例,女8例,年龄35~90岁,平均(59.38±12.73)岁,BMI平均(22.97±3.70)kg/m2;
对照组患者65例,其中男40例,女25例,年龄31~88岁,平均(57.75±9.80)岁,BMI(22.03±4.30)kg/m2。两组患者性别、年龄、BMI差异无统计学意义,具有可比性。
2.2 两组患者实验室检查指标情况 两组患者入院首次化验结果中AST、TBil、TP、PT、PTA差异具有统计学意义(P<0.05),见表1。
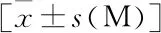
表1 两组患者实验室检查指标情况比较
2.3 两组患者腹部超声检查情况 观察组患者26例有腹水,8例无腹水;
对照组患者44例有腹水,21例无腹水;
组间比较差异无统计学意义。
2.4 两组患者临床情况 治疗方式上,观察组患者内科保守治疗8例,内镜下止血治疗24例,TIPS治疗2例;
对照组患者内科保守治疗37例,内镜下止血治疗24例,TIPS治疗4例;
差异具有统计学意义(P<0.01)。其中内科保守治疗患者HE发病率17.77%,内镜下止血患者HE发病率50%,TIPS治疗患者HE发病率33.33%。肝硬化病因方面,观察组患者酒精性肝硬化13例,乙型肝炎肝硬化12例,丙型肝炎肝硬化3例,药物性肝硬化0例,自身免疫性肝病2例,隐源性肝硬化4例;
对照组患者酒精性肝硬化26例,乙型肝炎肝硬化15例,丙型肝炎肝硬化2例,药物性肝硬化3例,自身免疫性肝病10例,隐源性肝硬化8例;
组间比较差异无统计学意义。临床结局方面,观察组患者死亡8例,死亡率23.53%;
对照组死亡3例,死亡率4.62%。
2.5 肝硬化消化道出血合并HE的危险因素分析 两组患者在AST、TBil、TP、PT、PTA、治疗方式上组间差异具有统计学意义,纳入二元Logistic回归分析,运用逐步后退法,得出AST、PTA、TP、治疗方式与肝硬化消化道出血合并HE具有显著相关性。其中TP和AST越高、PTA越低则患者越容易合并HE,与其他治疗方式相比,采用内镜下止血治疗的患者更容易合并HE,见表2。
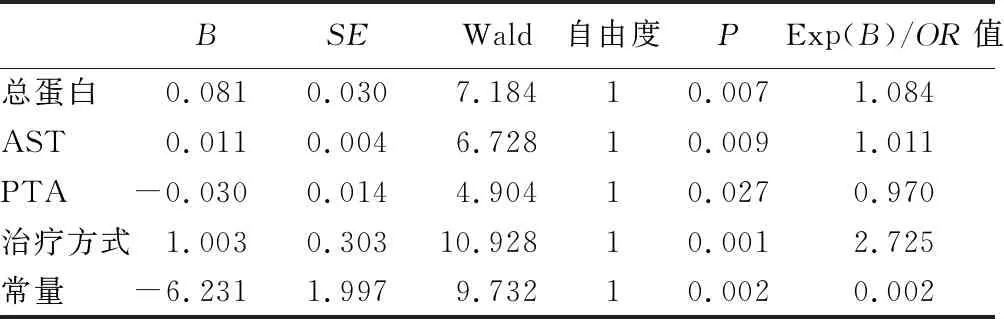
表2 肝硬化消化道出血合并HE的危险因素分析
肝性脑病是由是由急、慢性肝功能严重障碍或各种门静脉-体循环分流异常所致的、以代谢紊乱为基础、轻重程度不同的神经精神异常综合征[3]。临床表现高级神经中枢的功能紊乱、运动和反射异常(内科)。HE最常见的诱发因素是感染,第二常见诱因便是消化道出血[3-5]。在本研究中,HE在肝硬化消化道出血患者中的发病率为34.34%,符合HE在肝硬化患者中的整体发病率(30%~45%)。本研究中观察组患者死亡率23.53%,是对照组患者死亡率(4.62%)的5倍,显著增加了肝硬化消化道出血患者的死亡率,因此对早期对肝硬化消化道出血合并HE的风险进行预判意义在重大,尽早进行临床干预,以减少HE的发生,减低肝硬化消化道出血患者的死亡率。
肝性脑病的发病机制目前主要有[3,6]:血氨升高的氨中毒学说;
γ-氨基丁酸、谷氨酸、假性神经递质、5-羟色氨酸、胆碱能系统相关的神经递质改变学说;
感染、全身炎症反应等;
锰中毒;
肠道菌群紊乱;
脑干网状系统功能紊乱等。消化道出血后,肠道内聚焦大量的血液,部分血液被吸收代谢,导致体内血氨等毒素升高,是消化道出血诱发HE的主要机制。但研究对象消化道出血已然存在,不可避免,除了血氨等毒素升高,还有哪些因素可促进合并HE的发生呢?基于这个问题,我们设计了本研究。
在本研究中Logistic回归分析结果显示血清总蛋白含量(B=0.081,OR=1.084)越高、AST(B=0.011,OR=1.011)越高及PTA(B=-0.03,OR=0.970)越低越容易合并HE。血清总蛋白主要由血清球蛋白(GLO)及白蛋白(Alb)组成,两组患者Alb经t检验统计分析得出P=0.776>0.05,不具有统计学差异,因此可以认为观察组患者平均GLO含量大于对照组患者。有研究指出,肝硬化患者的血清GLO水平能反映肝功能损害程度,其与肝组织炎症活动及肝细胞损伤程度呈正相关[7]。其水平还能反映肝组织的纤维化程度,当纤维化程度≥2时,血清GLO水平与肝纤维化程度正相关[8]。血清GLO是人体除血清Alb外所有蛋白的总称,肝硬化患者GLO水平升高的主要原因是血清免疫GLO水平的升高[9]。有研究显示血清免疫GLO越高,其肝纤维化面积比例越高,肝硬化程度越重[10]。AST主要存在肝细胞线粒体内,当严重肝细胞损伤时,肝细胞内线粒体膜亦损伤,可导致线粒体内AST释放入血,因此血清AST可代表肝脏损伤程度。PTA是由PT通过计算公式得出,代表患者的PT相当于正常值的百分之几[11],亦是用于评价肝脏功能的指标,其值越低肝脏功能越差。综上所述,本研究中观察组血清总蛋白、AST较对照组高及PTA较对照组低,都代表了观察组的肝脏损伤程度更重,因此更容易合并HE。
另外,Logistic回归分析方程中,治疗方式(1=药物保守治疗、2=药物基础上行TIPS、3=治疗药物基础上行内镜下止血)与肝硬化消化道出血呈正相关(B=1.003,OR=2.725,)。总体上内科保守治疗患者HE发病率17.77%,TIPS治疗患者HE发病率有33.33%,内镜下止血患者HE发病率50%。可见内镜下止血治疗更容易合并HE。分析其原因,我院消化道出血患者内镜下止血均在全身麻醉下操作,TIPS治疗局部麻醉下操作,而麻醉药物应用也是HE的诱因[3],因此全身麻醉下行内镜下止血患者HE发病率可能更高。
综上所述,肝硬化消化道出血患者TP和AST越高、PTA越低则越容易合并HE,全身麻醉下行内镜下止血治疗有可能更容易诱发HE。由于本次研究为回顾性研究,病例数偏小,研究结论有待大样本进一步验证。
猜你喜欢 脑病消化道死亡率 全面的健康生活方式显著降低糖尿病死亡率中老年保健(2022年5期)2022-11-25发育性癫痫性脑病75型家系的遗传学分析中华实用诊断与治疗杂志(2022年1期)2022-08-31MRI,CT检查诊断酒依赖致慢性酒精中毒性脑病的效果对比中国典型病例大全(2022年10期)2022-05-10循证护理在缺氧缺血性脑病新生儿护理中的应用效果分析中国典型病例大全(2022年10期)2022-05-10走路可以降低死亡率中老年保健(2021年4期)2021-08-22大面积烧伤并发消化道溃疡大出血及胸腹腔感染1例感染、炎症、修复(2021年1期)2021-07-28春季养鸡这样降低死亡率今日农业(2021年5期)2021-05-22消化道出血有哪些表现?若有这4个,是时候注意了,如何护理科学导报·学术(2020年47期)2020-11-17新冠肺炎的死亡率为何难确定?科学之谜(2020年6期)2020-08-11肝硬化并发症:肝性脑病中国医学创新(2016年33期)2017-02-28