冯 庆,李 涛,李筱漾,梁洪峰,陈赛琼,彭 鹏
(1.广西医科大学第一附属医院放射科,广西 南宁 530021;
2.柳州市工人医院放射科,广西 柳州 545000)
造血干细胞移植(hematopoietic stem cell transplantation, HSCT)是治疗造血系统疾病和血液系统恶性肿瘤的常用方法[1]。移植物抗宿主病(graft versus host disease, GVHD)为HSCT后严重并发症之一,平均发生率达59%[2]。GVHD是供体T淋巴细胞与受体上皮细胞发生免疫反应[3],进而对受体组织器官发动免疫攻击所致,常累及皮肤、胃肠道和肝脏[4];
急性GVHD累及胃肠道即为胃肠道GVHD(gastrointestinal GVHD, GI-GVHD),临床常表现为腹痛、恶心、呕吐、腹泻、发热和体质量下降,如未能及时给予免疫抑制治疗,死亡率达50%[5];
快速准确诊断GI-GVHD具有重要临床意义。内镜及组织活检病理是诊断GI-GVHD的金标准,但在血小板减少和凝血功能障碍患者属于禁忌证。本研究观察CT鉴别诊断HSCT后GI-GVHD与机会性感染性肠炎的价值。
1.1 一般资料 回顾性分析广西医科大学第一附属医院及柳州市工人医院2018年1月—2022年1月收治的59例因白血病或地中海贫血而接受HSCT后出现胃肠道症状患者,经内窥镜下组织活检病理确诊其中31例GI-GVHD(GI-GVHD组)、28例机会性感染性肠炎(机会性感染性肠炎组)。GI-GVHD组男19例、女12例,年龄5~66岁、中位年龄14岁;
均有不同程度腹泻,其中5例消化道出血、4例腹痛、3例腹胀;
5例为急性GI-GVHD(于HSCT后100天内发病)[2],26例为慢性GI-GVHD(于HSCT后100天以后发病)。机会性感染性肠炎组男16例、女12例,年龄11~45岁、中位年龄15岁,均有不同程度腹痛、腹泻及腹胀,无消化道出血者。排除标准:①同时存在GI-GVHD和机会性感染性肠炎或其他并发症;
②确诊HSCT前患有胆道疾病或膀胱疾病。
1.2 仪器与方法 检查前嘱患者口服500 ml温水。采用Siemens Somatom Definition Flash双源CT机,于内窥镜检查前2周内行仰卧位全腹扫描,于吸气末采集图像,扫描范围自膈顶至耻骨联合;
参数:管电压120 kVp,管电流200~300 mAs,螺距1∶1,层厚和层间距均为3 mm。平扫结束后,经肘静脉以流率4.0 ml/s注射1.0~1.5 ml/kg体质量碘海醇(350 mgI/ml,),以相同流率跟注10 ml生理盐水后行增强扫描。
1.3 图像分析 由2名具有10年以上腹部影像学诊断经验的副主任医师采用盲法独立阅片,统一调节图像为窗宽450 HU、窗位20 HU,对比观察2组肠内及肠外CT表现。肠内CT表现:①肠壁增厚,肠壁厚度≥4 mm;
②肠壁强化,增强图像见明显强化的充血肉芽组织及纤维组织与在其外周的低张力肠壁外层共同形成“环靶征”[6],或肠壁全层水肿、强化;
③肠管积气,积气的小肠肠管直径≥3 cm、大肠肠管直径≥8 cm;
或肠腔内积气聚集于黏膜下而形成黏膜下小气囊;
④多灶性肠壁炎症,将病变同时累及小肠和大肠定义为多灶性肠壁炎症,反之为单一节段肠壁炎症。肠外CT表现:①肠周围淋巴结增生,病变肠管周围见小的增大淋巴结(直径>5 mm或数目>3个);
②胆囊炎,胆囊壁增厚并明显强化,胆囊窝积液或胆囊内见胆汁淤积;
③肠系膜水肿,肠系膜强化及肠系膜血管增生呈“齿梳状”改变,周围脂肪间隙模糊;
④膀胱炎或膀胱出血,膀胱壁厚度≥3 mm或膀胱腔内见非结石所致片絮状高密度影。
1.4 统计学分析 采用SPSS 26.0统计分析软件,以χ2检验或Fisher精确概率检验比较计数资料,P<0.05为差异有统计学意义。
2组患者一般资料差异均无统计学意义(P均>0.05,表1)。
2.1 肠内CT表现 GI-GVHD组27例肠壁增厚5~7 mm,18例见“环靶征”,17例见全腹肠腔积气或黏膜下散在小气囊,7例多灶性肠壁炎症,5例肠壁全层强化;
上述表现发生率组间差异均有统计学意义(P均<0.05)。见表2及图1。
2.2 肠外CT表现 2组均见肠系膜水肿及 “齿梳状”改变,组间差异无统计学意义(P>0.05)。GI-GVHD组多见肠周淋巴结增生、胆囊壁明显增厚及强化,且易合并膀胱炎或膀胱出血,上述各项发生率组间差异均有统计学意义(P均<0.05)。见表2及图2。
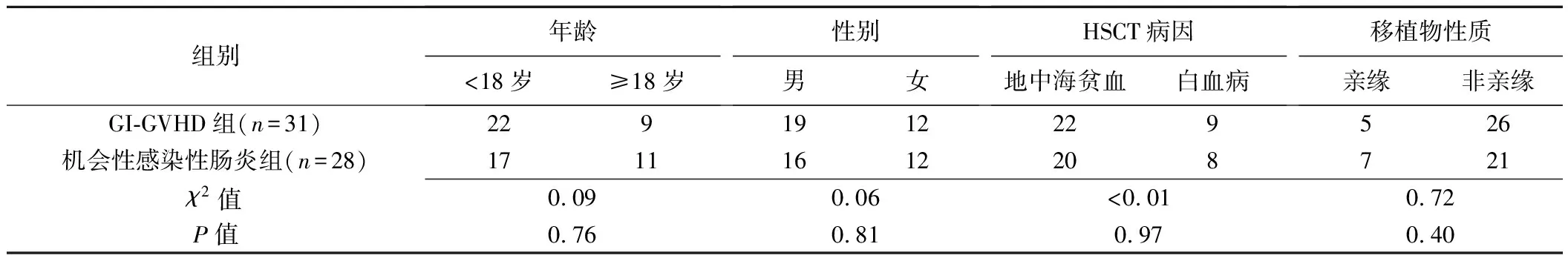
表1 HSCT后GI-GVHD或机会性感染性肠炎患者一般资料比较(例)

表2 HSCT后GI-GVHD与机会性感染性肠炎CT表现比较(例)

图1 患儿男,11岁,地中海贫血,急性GI-GVHD A、B.腹部轴位(A)及冠状位(B)增强CT图示乙状结肠壁增厚水肿,黏膜明显异常强化,左半结肠扩张、积气,黏膜下多发小气囊形成(箭);
C.胃肠镜图示大肠及回肠末端黏膜重度充血、水肿,弥漫潮红,蠕动差;
D.病理图(HE,×100)示乙状结肠黏膜充血、水肿,肉芽组织形成,毛细血管及纤维结缔组织增生,未见肠黏膜被覆上皮
早期诊断及治疗对改善GI-GVHD患者预后至关重要。目前对GI-GVHD主要采用免疫抑制治疗,如误诊为机会性感染性肠炎应用抗感染治疗会延误病情,导致病情恶化。现行诊断GI-GVHD金标准为内镜及组织活检病理学检查[7],但GI-GVHD临床症状缺乏特异性,其肠道病变可仅见于小肠或大肠,亦可同时发生于小肠及大肠而呈多灶性,通过内镜检查无从知晓其无法抵达处的肠管组织结构及周围组织改变,并易诱发肠出血,且内镜检查结果并非总与组织病理学结果一致[8],目前对于活检最佳部位尚无统一认识,使得通过影像学检查鉴别GI-GVHD与机会性感染性肠炎具有一定临床意义。本研究观察根据腹部CT表现鉴别GI-GVHD与机会性感染性肠炎的价值。
HSCT后GVHD易引起全身T淋巴结细胞与上皮细胞的共同免疫反应,累及多个肠外器官;
而机会性感染性肠炎较少累及肠外组织。本研究发现,肠壁增厚、肠壁强化及肠管积气发生率组间差异均有统计学意义。GI-GVHD组87.10%(27/31)肠壁增厚,与既往报道[9]一致,提示肠壁增厚为GI-GVHD最常见CT表现。BRODOEFEL等[10]报道,GI-GVHD肠管扩张发生率为94%,认为多发、充满液体、气体的肠管扩张是GI-GVHD特征性CT表现之一;
本研究GI-GVHD组肠管扩张积气发生率为54.84%(17/31)。GI-GVHD的主要组织学特征是上皮细胞凋亡及腺体或隐窝细胞退化,凋亡细胞内包含充满碎片的空泡;
晚期可见隐窝囊性扩张、隐窝脓肿、上皮坏死和黏膜完全脱落[11];
多个隐窝脓肿产生较多气体,不融合时表现为黏膜下小气囊,融合则致肠管扩张、积气明显。本研究GI-GVHD组肠壁强化发生率(23/31,74.19%),高于机会性感染性肠炎组(16/28,57.14%);
且“环靶征”更明显。SHIMONI等[12]认为急性GI-GVHD肠壁强化发生率仅16%,或为观察对象处于GI-GVHD不同阶段所致。
在GVHD慢性期,组织明显纤维化,此时出现“环靶征”可能是肠黏膜重度纤维化所致[8]。本研究GI-GVHD组31例中,慢性GVHD占83.87%(26/31)[13],其肠壁强化明显。GI-GVHD病变通常呈斑片状分布,可能需要针对多部位进行活检方可确诊。本研究GI-GVHD组7例出现多灶性肠壁炎症,发生率为22.58%(7/31),小肠及结肠同时受累,与机会性感染性肠炎组差异无统计学意义。急性GVHD的组织学特征则是胆管损伤、胆道上皮细胞发生改变,包括核间距不均匀、核大小改变、胞质空泡化,少见凋亡和坏死,伴胆汁淤积;
随时间推移,可见胆囊壁增厚及胆囊窝积液等胆囊炎表现[14]。本研究GI-GVHD组多见肠周淋巴结增生、胆囊壁明显增厚及强化,易合并膀胱炎或膀胱出血等肠外CT表现,与SHIMONI等[12]报道相似。

图2 患者女,22岁,急性髓系白血病,慢性GI-GVHD A、B.腹部冠状位(A)及轴位(B)增强CT图示小肠及结肠见多灶性炎症,黏膜明显强化,可见“环靶征”,肠系膜明显水肿而呈“齿梳状”改变,系膜周围见小淋巴结增生,胆囊壁增厚并强化
综上,CT有助于鉴别诊断HSCT后GI-GVHD与机会性感染性肠炎。但本研究为回顾性分析,样本量有限,有待积累病例、开展多中心前瞻性研究进一步观察。
猜你喜欢 肠壁肠炎肠管 马属动物腹股沟阴囊疝的辨证施治中国畜禽种业(2022年4期)2022-11-22CT小肠造影在鉴别克罗恩病活动分期中的应用价值中国临床新医学(2022年9期)2022-10-11超声检查对新生儿坏死性小肠结肠炎手术决策的意义探讨临床小儿外科杂志(2022年4期)2022-07-16超声引导下床旁鼻空肠管置入术在危重患者肠内营养中的应用研究中国典型病例大全(2022年9期)2022-04-19基于塞丁格技术的套管法在更换鼻肠管中的临床应用效果上海护理(2021年4期)2021-12-01肠壁增厚分层并定量分析对小肠坏死的诊断价值罕少疾病杂志(2021年4期)2021-07-28冬季鸡肠炎易发 科学防治有方法今日农业(2021年1期)2021-03-19感染性肠炎如何应对家庭医药·快乐养生(2020年11期)2020-12-03肠炎的症状有哪些保健文汇(2020年11期)2020-12-03肠炎是如何引起的、生活中该注意什么?大众科学·下旬(2019年6期)2019-09-10