刘彬,彭正加,梁分凤,廖俊
(1.湘潭医卫职业技术学院附属医院 耳鼻咽喉头颈外科,湖南 湘潭 411104;
2.湘潭市中心医院 耳鼻咽喉头颈外科,湖南 湘潭 411100)
喉癌是最常见的一种头颈部肿瘤,约占头颈部肿瘤总数的四分之一[1],其中喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)又占喉部恶性肿瘤的90%,在男性中多见[2-3]。目前临床主要的治疗策略是手术切除联合放/化疗,但是大多数的LSCC患者仍存在再次复发的风险,5年生存率不超过60%[1,4],治疗效果不及预期,因此迫切需要寻找喉癌中新的分子机制以期为LSCC的治疗提供新的见解。ECRG4是一种高度保守的抑癌基因,能够编码Gauurin、ECLIN等多种生物肽,参与肿瘤抑制、细胞衰老和免疫反应等许多生理现象[5]。ECRG4被激活后从细胞膜上释放出来,并能在体液中检测到,是精准医学中一个绝佳的候选基因[6]。研究发现ECRG4的异常表达常受启动子区域的甲基化所抑制,ECRG4甲基化水平可能成为胃癌、肾细胞癌诊断或预后评估中的分子标记物[7-8]。而遗憾的是,ECRG4目前鲜有在LSCC中的报道,本次研究通过分析LSCC中ECRG4 mRNA、蛋白以及启动子甲基化水平,探讨ECRG4在LSCC中的临床意义,现报道如下。
1.1 人类蛋白图谱(human protein atlas,HPA)数据库分析
HPA是人类组织和细胞蛋白质分布的最大最全面的数据库(https://www.proteinatlas.org/)[9],可以运用于肿瘤组织样本中的蛋白表达分析,本次研究主要通过HPA数据观察ECRG4在不同头颈部肿瘤组织中的表达情况。
1.2 基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)数据库
GEPIA是一个基于基因型组织表达(genotype-tissue expression,GTEx)数据进行分析的在线工具(http://gepia.cancer-pku.cn),可以对提交的基因进行差异表达分析、轮廓图绘制、相关性分析、患者生存分析,相似基因检测和降维分析等在内的全面表达分析[10],本次研究中主要通过GEPIA数据库分析ECRG4在头颈部鳞状细胞癌中的表达情况。
1.3 患者样本
收集湘潭市中心医院2017年12月—2018年12月收治的15例原发LSCC患者的组织样本及对应的癌旁正常组织样本(距离病灶>2 cm),以上患者均经过病理学确诊。组织样本经生理盐水清洗后,立即剪切成2~5 mm薄片放入RNALater(SIGMA,R0901)中,4 ℃过夜后转至-80 ℃冰箱中冻存;
剩余组织进行病理分析。一般临床资料见表1,所有患者术前6个月未接触过放/化疗,经病理科确诊,且签署了完整的知情同意书。
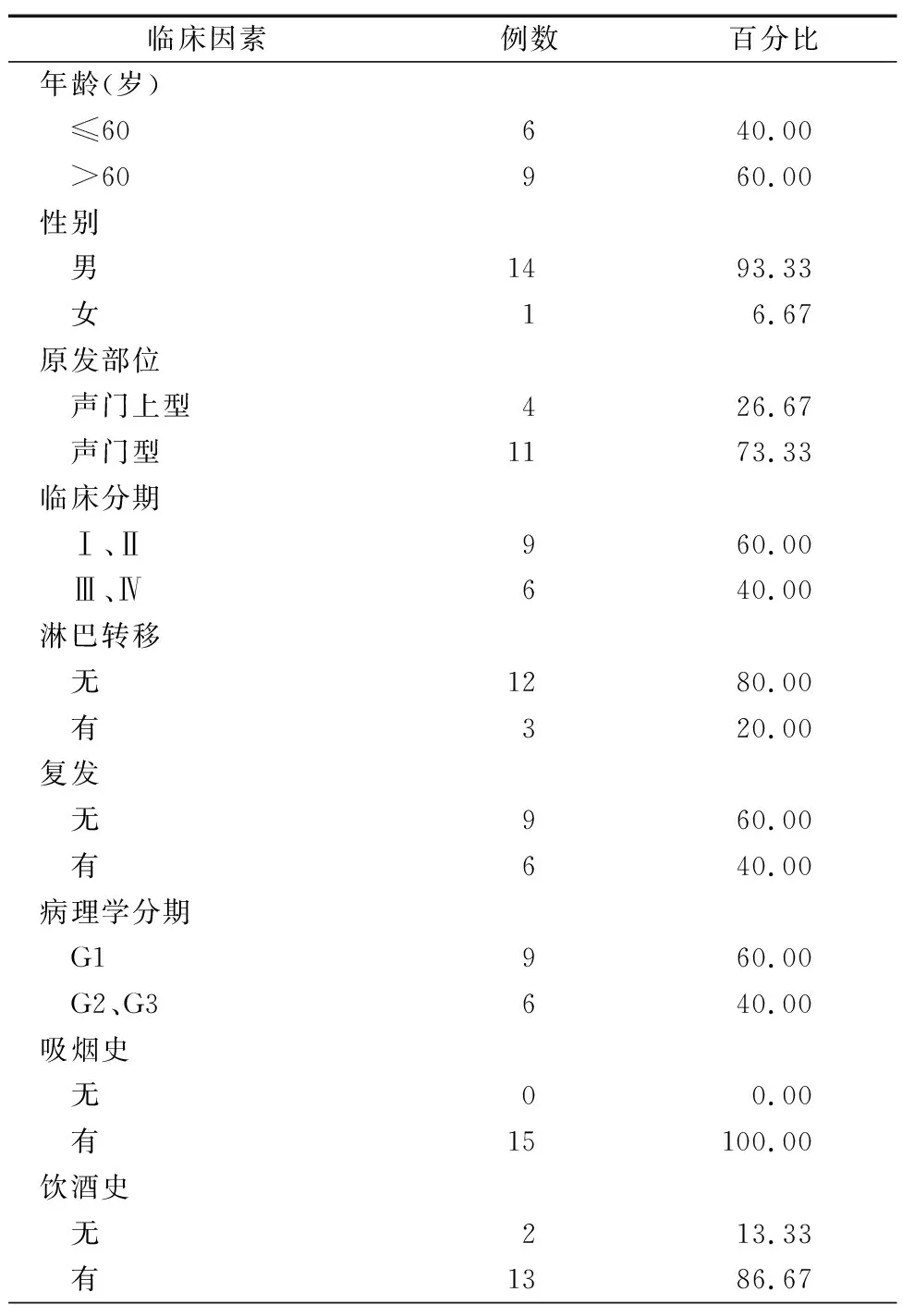
表1 15例LSCC患者的一般临床资料 (例,%)
1.4 实时荧光定量PCR(RT-qPCR)
使用RT-qPCR检测肿瘤组织和癌旁正常组织中ECRG4 mRNA的相对表达水平,使用Trizol提取组织和细胞中的总RNA,使用琼脂凝胶电泳以及NanoDrop(Thermo,One)检测RNA的完整性、纯度以及浓度,使用HiFiScriptgDNA Removal cDNA Synthesis Kit(康为世纪,CW2582M)合成cDNA文库,使用TB GreenTMPremix DimerEraserTM(TaKaRa,RR091B)在荧光定量PCR仪(AppliedBiosystems,QuantStudioDx)上检测ECRG4 mRNA的相对表达量,98 ℃预变性2 min后,98 ℃变性15 s,60 ℃退火/延伸30 s,重复40个循环。以ACTB为内参基因,引物序列见表2,采用2-ΔΔCt进行计算。
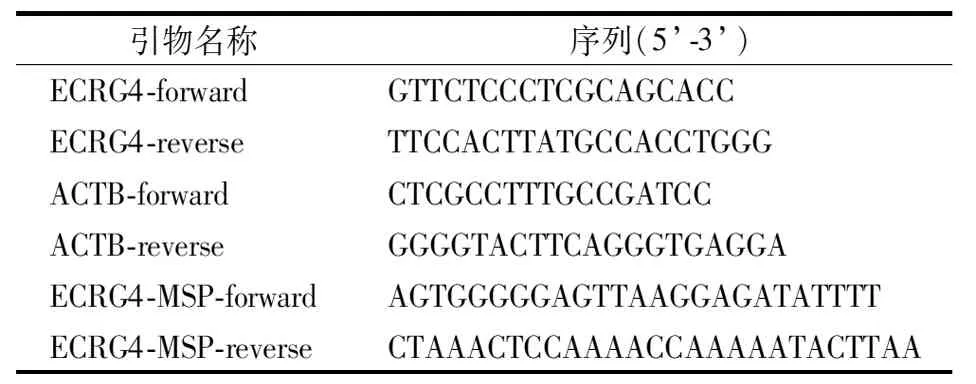
表2 引物序列
1.5 甲基化特异性PCR(MSP)及ECRG4启动子甲基化核心区域测序
首先使用QIAamp DNA 试剂盒(qiagen,51304)提取样本中的DNA,使用荧光定量仪(Thermo Fisher Scientific,Qubit 3.0)和Nanodrop(进行定量和纯度检验。使用EpiTect Fast DNA Bisulfite Kit(Qiagen,59824)对两组样品分别进行重亚硫酸盐转化,60 ℃ 15 min。使用TaKaRaEpiTaqTMHS(TaKara,R110A)对ECRG4启动子核心区域(Chr2:106065304-106065523)进行扩增,扩增引物序列如表2所示,98 ℃预变性2 min后,98 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,重复30 cycles),72 ℃ 5 min。使用AMPure XP Beads(Beckman,A63881)回收PCR产物。使用Ion Plus Fragment Library Kit(Thermo Fisher Scientific,4471252)对扩增产物进行文库构建。经Agilent2100 和KAPA Library Quantification Kit(KAPABiosystems,KK4827)进行文库质检和精确定量后,使用Ion PI Hi-Q OT2 Kit(Thermo Fisher Scientific,A26434)制备模板。使用Ion PI Hi-Q Sequencing200 Kit(Thermo Fisher Scientific,A26433)和Ion PI V3芯片在Ion Torrent Proton平台进行测序并读取ECRG4启动子甲基化水平。
1.6 Western blot
使用蛋白提取试剂盒(Solarbio,BC3790)抽提组织中的总蛋白,经BCA蛋白浓度测定试剂盒(Gbcbio,G3522)对蛋白进行定量,12%SDS-PAGE凝胶电泳分离,常规转移至PVDF膜上,室温下使用5% BSA(Solarbio,A8010)进行封闭2 h,TBST(Solarbio,T1081)洗涤,加入稀释好的一抗(abcam,ab224077),4 ℃孵育过夜,TBST再次洗涤,加入相应二抗(ab205719)进行孵育,冲洗3次,每次10 min,最后使用ECL化学发光试剂盒(Solarbio,SW2010)进行检测。使用GAPDH(ab8245)为内参。
1.7 统计学方法

2.1 ECRG4在头颈部鳞状细胞癌中低表达
通过HPA数据库观察ECRG4的表达情况,如图1A所示,在病理模块中,头颈部鳞状细胞癌中几乎检测不到ECRG4的表达,而在头颈部腺癌中,ECRG4表现出中等强度的信号(图1B)。进一步使用GEPIA在线工具分析ECRG4在头颈部鳞状细胞癌中的表达(图1C),结果表明,ECRG4在头颈部鳞状细胞癌肿瘤组织中的表达明显较正常组织中低(P<0.05)。

图1 ECRG4在头颈部鳞状细胞癌中低表达 A:HPA数据库分析ECRG4在头颈部鳞状细胞癌中组织的表达;
B:HPA数据库分析ECRG4在头颈部腺癌组织中的表达;
C:GEPIA数据库分析ECRG4在头颈部鳞状细胞癌肿瘤组织以及正常组织中的表达 注:HNSC(头颈部鳞状细胞癌)。
2.2 ECRG4在LSCC中表达下调
使用RT-qPCR检测ECRG4 mRNA在LSCC患者肿瘤组织和癌旁正常组织中的表达,与癌旁正常组织相比,ECRG4在肿瘤组织中的表达下调(P<0.05),进一步使用Western blot检测组织中的蛋白表达,结果表明ECRG蛋白在肿瘤组织的表达较癌旁正常组织中低,详见图2。
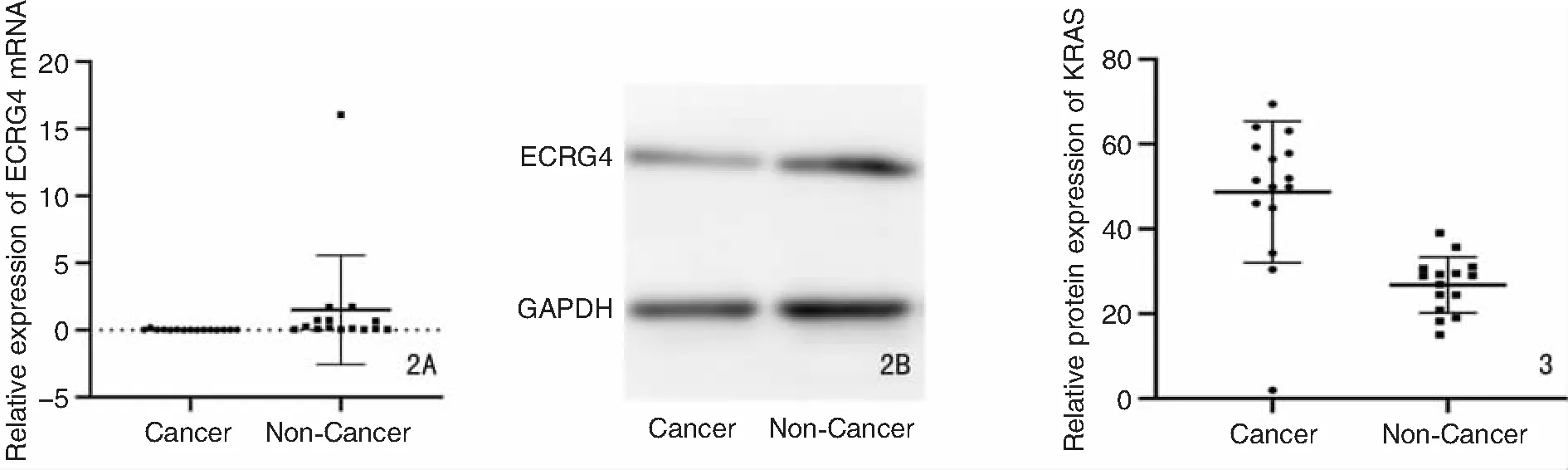
图2 ECRG4在LSCC中表达下调 2A:RT-qPCR检测ECRG4 mRNA在LSCC患者肿瘤组织和癌旁正常组织中的表达;
2B:Western blot检测ECRG4蛋白在LSCC患者肿瘤组织和癌旁正常组织中的表达 图3 LSCC中ECRG4启动子甲基化水平升高
2.3 LSCC中ECRG4启动子甲基化水平升高
使用MSP及核心区域测序检测ECRG4启动子甲基化水平,如图3中所示,LSCC肿瘤组织中的甲基化水平明显高于癌旁正常组织中,差异具有统计学意义(P<0.05)。
2.4 ECRG4的mRNA表达及甲基化水平与患者临床病理特征之间的关系
综合15例LSCC患者的一般临床资料,总结ECRG4的mRNA表达及甲基化水平与患者临床病理特征之间的相关性,结果发现,ECRG4 mRNA表达与患者的临床分期、淋巴转移、复发、病理学之间存在相关性,Ⅲ、Ⅳ期、存在淋巴转移、复发以及G2、G3期的患者肿瘤组织中ECRG4 mRNA表达更低(P<0.05)。而Ⅲ、Ⅳ期、复发以及G2、G3期的患者肿瘤组织中的ECRG4启动子甲基化水平升高更明显(P<0.05),详见表3。

表3 ECRG4的mRNA表达及甲基化水平与患者临床因素之间的关系
我们本次研究首先通过HPA和GEPIA数据库确定了ECRG4在头颈部肿瘤中的表达,发现其在头颈部鳞状细胞癌中表达较其他组织类型和正常组织中下降明显。然后对收集来的LSCC患者的肿瘤组织和正常组织进行RT-qPCR检测,发现ECRG4 mRNA在肿瘤组织中低表达,Western blot实验结果进一步在蛋白水平上证明了这一点。
ECRG4,又称C2orf40,其长度为12.5kb,位于染色体2q12.2上,由4个外显子组成,编码148个氨基酸残基的多肽,大量研究报道,ECRG4在食管鳞癌,神经胶质瘤以及结直肠癌等恶性肿瘤中表达下调[11]。而ECRG4编码的蛋白前体也在各种上皮恶性肿瘤中表观遗传沉默,其组成性分泌并束缚在上皮细胞或循环白细胞的细胞表面[12]。Cai等[13]将ECRG4转染至结直肠癌细胞中后,使用MTT、平板克隆和Annexin/PI双染法观察细胞的生物学功能变化,并在裸鼠体内进行致瘤效应检测,结果表明,ECRG4的过表达通过减少肿瘤体积和重量以及诱导肿瘤细胞凋亡而抑制肿瘤的发生,其可能是结直肠癌患者治疗的潜在靶点。除此之外,另有研究发现在人LSCC细胞Hep-2中过表达ECRG4后,细胞的迁移和侵袭能力明显受到抑制,NF-κB p65蛋白表达下调,ECRG4通过NF-κB信号通路介导Hep-2 EMT进程,抑制LSCC的转移[14]。这也从侧面辅证了我们的研究结果:ECRG4在LSCC中表达下调。
DNA甲基化是一个可以通过细胞分裂遗传的稳定表观遗传标记,但是在癌症的发生和发展过程中,由于染色质调节因子突变或解除管制,特定DNA会发生甲基化水平的变化,甲基化水平的差异也可以作为肿瘤诊断和药物治疗的有力分子标记[15]。ECRG4基因表达下调主要归因于ECRG4启动子的的5个非翻译区中CpG岛的甲基化,其核心启动子序列包含几个CpG岛、多个重叠的Sp1共有结合序列和一个假定的核转录因子-κB(nuclear transcription factor-κB, NF-κB)激活结合位点。ECRG4转录从ECRG4开放阅读框起始ATG的11位胍基起始。虽然在此翻译起始位点的5 ’UTR中有一个远端TATA序列,这也被确定为超甲基化的目标序列,因为编码ECRG4启动子的质粒的体外甲基化消除了启动子的活性,用甲基化抑制剂5-AzaC处理后会增加内源性ECRG4的表达[16]。我们在研究中也发现LSCC肿瘤组织中启动子甲基化水平较正常组织中升高,这也说明可能正是由于ECRG4启动子导致ECRG4表达下降。
另外通过比较不同临床病理特征的患者中的ECRG4 mRNA表达及甲基化水平,ECRG4 mRNA低表达与患者的临床分期、淋巴转移、复发、病理学之间存在相关性,而Ⅲ、Ⅳ期、复发以及G2、G3期的患者肿瘤组织中的ECRG4启动子甲基化水平升高更明显。研究发现ECRG4也是鼻咽癌患者的独立预后因素,ECRG4在鼻咽癌患者血清中的低表达与TNM高分期、转移、淋巴转移等临床特征之间具有显著的相关性[17]。另外在卵巢癌、食管癌、胃癌等相关ECRG4基因启动子甲基化的研究中发现,正常组织中ECRG4甲基化水平往往较低[18-20],并且ECRG4基因甲基化检出率与胃癌患者的病理分期相关,与患者的年龄、性别及淋巴转移无关[20],暗示ECRG4表达及甲基化水平能够反映一定的疾病进展。
综上所述,ECRG4在LSCC肿瘤组织中mRNA和蛋白表达水平下降,而甲基化水平升高,其表达及甲基化水平与患者的Ⅲ、Ⅳ期、复发以及G2、G3期的患者相关,有望为LSCC的治疗和研究提出新的分子靶点。
猜你喜欢 头颈部鳞状甲基化 端粒酶相关蛋白1在宫颈鳞状上皮病变中的表达*重庆医学(2022年12期)2022-07-05甲基苯丙胺改变成瘾小鼠突触可塑性基因的甲基化修饰昆明医科大学学报(2022年1期)2022-02-28腹针结合头颈部按摩治疗心脾两虚型失眠的临床研究健康之家(2021年19期)2021-05-23不同坐姿的6岁儿童乘员在MPDB碰撞测试中头颈部损伤评价汽车工程(2021年12期)2021-03-08DNA甲基化与基因活性的调控中学生物学(2020年10期)2020-12-25口腔鳞状细胞癌中PD-L1的表达与P16、HPV感染以及淋巴结转移关系分析实验与检验医学(2020年2期)2020-04-25细胞角蛋白14和P16在宫颈病变组织中的表达及其诊断价值肿瘤基础与临床(2018年3期)2018-01-15金匮肾气丸加减改善头颈部肿瘤患者生存获益中成药(2017年4期)2017-05-17肝癌组织hSulf-1基因表达与其甲基化状态的关系医学研究杂志(2015年12期)2015-06-10血清鳞状上皮细胞癌抗原联合宫颈液基薄层细胞检测应用于宫颈癌筛查的价值分析医学研究杂志(2015年12期)2015-06-10