袁 涛, 邢 蕊
北京大学肿瘤医院暨北京市肿瘤防治研究所胃肠肿瘤生物学研究室,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
根据2020年全球癌症统计数据显示,我国胃癌的发病率和死亡率均高居第三位[1]。癌细胞转移是胃癌患者死亡的主要原因之一[2],以往研究发现,即便是在肿瘤早期,肿瘤细胞也会发生转移[3],因此,鉴定导致转移的关键基因是防治胃癌转移、延长患者生存期的关键[4-5]。
以往研究表明,胃黏膜屏障的破坏是胃癌发生发展的始动因素[6-7]。黏蛋白家族是一种高度糖基化修饰的高分子量蛋白家族,由上皮组织产生,具有组织润滑及细胞信号转导等多种功能,是胃黏膜保护屏障的主要组成成分[8]。近年来,黏蛋白作为肿瘤分子标志物倍受重视。如MUC1在胃癌组织中高表达,且与患者预后不良密切相关[9];
MUC16在结直肠癌中高表达,且与患者预后呈负相关[10]。本实验室主要针对MUC17进行了系统研究。在前期研究中,我们发现MUC17在胃癌组织中高表达,且与患者预后呈正相关[11-12];
进一步研究发现,MUC17可以通过抑制NF-κB通路抵御炎症因子促进肿瘤细胞增殖的作用,从而延长患者生存期[11]。肿瘤细胞的恶性行为不仅与炎症相关,更与癌细胞的转移密不可分,因此,在本研究中我们着重阐述MUC17的表达与胃癌细胞转移的关系。
1.1 实验材料
1.1.1 组织标本和胃癌细胞:本研究使用的103例胃癌组织来自于北京大学肿瘤医院手术样本,所有患者在取材前均未接受任何放化疗等治疗,术后病理诊断均为原发胃癌。本研究获得北京大学肿瘤医院伦理委员会批准(批号:2018KT14)。本研究所用胃癌细胞系AGS为贴壁细胞,购自ATCC(The Global Bioresource Center),使用含1%青霉素-链霉素、质量浓度为100 g/L胎牛血清的DMEM培养基,在37 ℃、体积分数为5%的CO2条件下培养。
1.1.2 主要试剂:FuGENE HD转染试剂(E2311,Promega,美国),兔抗人MUC17抗体(HPA031634,Sigma,美国)。
1.2 实验方法
1.2.1 免疫组化:胃癌组织样本经中性福尔马林溶液固定、石蜡包埋后制备白片,按如下步骤进行免疫组化实验:石蜡切片脱蜡至水,高压抗原热修复,3% H2O2室温孵育10 min清除内源性过氧化氢酶活性,质量浓度为50 g/L的脱脂奶粉室温孵育1 h封闭,滴加稀释后的MUC17抗体4 ℃过夜孵育,PBS冲洗5 min×3次,辣根过氧化物酶标记的二抗室温孵育30 min,PBS冲洗5 min×3次,DAB显色,苏木素复染,流水返蓝,封片。
1.2.2 细胞转染:参照文献设计出针对MUC17进行干扰的靶序列:ATACCAACCTCGACTCTTA[11]。根据靶序列,按照pSilencer质粒说明书人工合成一对互补并编码siRNA的寡核苷酸链。将1 μl 2 μmol/L的正、反义寡核苷酸链混合,加热至95 ℃并缓慢冷却至室温,形成双链。用BamHI与HindIII双酶切pSilencer载体质粒,琼脂糖电泳纯化回收后在T4连接酶催化下与退火形成的双链连接,并转化大肠杆菌DH5α。提取质粒,经测序对重组载体进行验证。细胞转染前1 d,将AGS细胞接种于培养皿中,待细胞融合度为60%~80%时,依据Promega FuGENE HD试剂说明书,将混匀后的转染试剂-质粒混合物加入细胞培养基中(转染试剂∶质粒=3∶1),在37 ℃、体积分数为5%的CO2条件下培养48 h。
1.2.3 Transwell实验:消化AGS细胞于含质量浓度为20 g/L胎牛血清的培养基,将含2×105个细胞的100 μl细胞悬液加入上室中,下室中加入800 μl含质量浓度为100 g/L胎牛血清的培养基,在37 ℃、体积分数为5%的CO2条件下培养24 h。取出Transwell小室,转移至预先加入PBS的孔中洗3次,4%多聚甲醛室温固定15 min,0.1%结晶紫室温染色15 min。
1.2.4 TCGA数据分析:我们用GEPIA2数据库(http://gepia2.cancer-pku.cn)[13]分析TCGA胃癌样本中MUC17和CDH1表达的相关性,使用Pearson相关性分析。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析。MUC17的表达与胃癌患者转移相关性分析采用χ2检验。P<0.05为差异有统计学意义。
2.1 MUC17的表达与胃癌转移呈负相关为了确定MUC17对胃癌细胞转移的影响,我们首先利用免疫组化实验在103例胃癌组织中检测了MUC17的表达与胃癌远端转移的相关性。如表1所示,MUC17的表达与胃癌转移呈负相关。如图1所示,相对于发生转移的原位癌,MUC17高表达于未发生转移的原位癌。

表1 MUC17的表达与远端转移的相关性
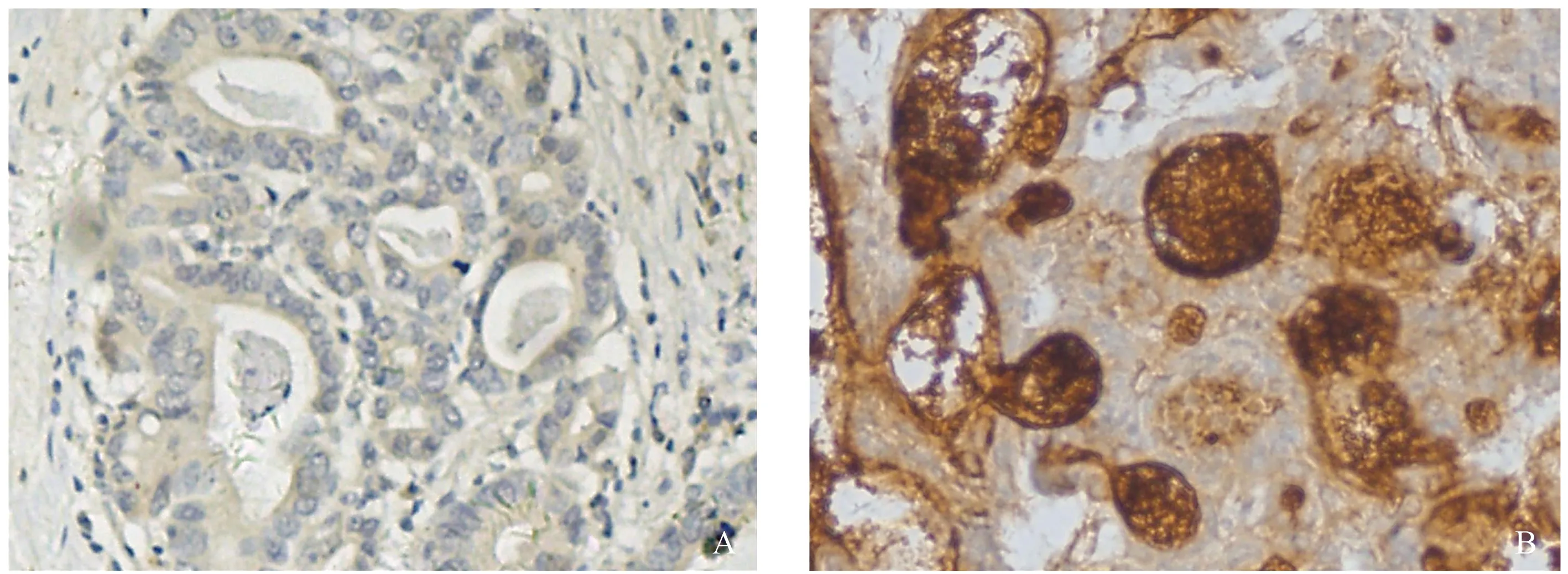
图1 用免疫组化在发生(A)/未发生(B)转移的原位癌中检测MUC17的表达(放大100倍)
2.2 MUC17抑制胃癌细胞的转移为了研究MUC17对胃癌细胞转移的影响,我们进行了Transwell实验。如图2所示,在胃癌细胞AGS中干扰MUC17的表达后,AGS细胞的转移能力明显增加。

注:A~B:在AGS细胞中用Transwell实验检测干扰MUC17的表达对胃癌细胞转移的影响,A为CTRL,B为sh-MUC17,放大200倍;
C:Transwell实验中迁移AGS细胞数的直方图。n=3。
2.3 MUC17的表达与CDH1的表达呈正相关CDH1基因编码的E-钙黏蛋白是钙依赖性细胞黏附蛋白,参与调节细胞粘附、迁移,其功能缺失导致肿瘤细胞的侵袭与转移[14-15]。为了阐明MUC17抑制胃癌细胞转移的机制,我们利用TCGA数据分析MUC17与CDH1表达的相关性。如图3所示,MUC17的表达与CDH1的表达呈正相关(R=0.46,P<0.001)。

图3 利用TCGA数据分析MUC17与CDH1表达的相关性
我们前期的研究发现,MUC17具有抑制胃癌细胞增殖、抵御炎症因子促进肿瘤细胞增殖的作用,以及抑制幽门螺杆菌毒力蛋白CagA转运至上皮细胞的功能[11-12],本研究又发现该基因具有抑制肿瘤细胞迁移的能力。研究发现MUC17在胃癌组织中高表达,即便是在肿瘤早期也可以检测到MUC17的高表达,且其表达与患者预后呈正相关。综合MUC17的表达和功能,我们推测MUC17是机体的保护因素,其高表达可抑制肿瘤的恶性行为,延长患者生存期。
已有研究表明,CDH1基因所编码的E-cadherin具有抑制肿瘤转移的功能[16],其低表达是肿瘤细胞发生转移的重要事件[17]。利用TCGA数据,我们发现在胃癌组织中MUC17的表达与CDH1的表达呈正相关,提示MUC17可能通过调控E-cadherin的表达抑制胃癌的转移。在下一步研究中我们将阐释MUC17调控CDH1表达的机制,为揭示胃癌转移的机制提供新的思路。
猜你喜欢 室温免疫组化质粒 室温过高加剧低血压?不准确家庭医药(2021年8期)2021-07-28mcr-1阳性类噬菌体质粒与F33∶A-∶B-质粒共整合形成的融合质粒的生物学特性分析江西农业学报(2021年4期)2021-04-20室温采集装置及供热二级管网智能化改造煤气与热力(2021年2期)2021-03-19药品保存细解读父母必读(2021年3期)2021-02-04夏枯草水提液对实验性自身免疫性甲状腺炎的治疗作用及机制研究浙江医学(2020年9期)2020-07-01婴幼儿原始黏液样间叶性肿瘤一例及文献复习浙江中西医结合杂志(2019年4期)2019-05-05结直肠癌组织中SOX9与RUNX1表达及其临床意义浙江医学(2019年2期)2019-01-23子宫瘢痕妊娠的病理免疫组化特点分析中国继续医学教育(2015年1期)2016-01-06重组质粒rAd-EGF构建并转染hDPSCs对其增殖的影响西南医科大学学报(2015年1期)2015-08-22甲氧基MQ树脂补强缩合型室温硫化硅橡胶的研究橡胶工业(2015年8期)2015-07-29