熊昊杰 申晨晨 马 艳
砷是广泛分布于自然界的类金属元素,多数流行病学研究、体内及体外细胞实验表明,砷暴露具有神经毒性。大脑作为砷中毒的靶器官之一,砷可以透过血-脑脊液屏障或胎盘屏障在脑组织中蓄积,长期接触会导致慢性砷中毒进而增加神经系统紊乱的风险[1~4]。由于神经细胞对有毒物质较为敏感且不容易再生,使得砷对神经系统的毒性研究显得尤为重要。目前砷致神经发育毒性的具体机制尚不明确,其多集中在凋亡、氧化应激、信号通路改变等方面,而信号通路的交叉融合对砷诱导的细胞凋亡及其之间的相互关系受到广泛关注[5~8]。有研究表明,核因子-类胡萝卜素2相关因子(nf-e2-related factor 2,Nrf2)、河马(Hippo)信号通路的激活和调控是影响细胞凋亡的关键因素之一[9, 10]。而关于砷致神经干细胞凋亡的机制研究相对较少,因此,本研究主要研究亚砷酸钠对小鼠神经干细胞(NE-4C细胞)增殖、Nrf2及Hippo信号通路相关分子表达水平的影响,从分子水平上探究砷致神经干细胞损伤的可能机制。
1.细胞株:小鼠神经干细胞(NE-4C细胞),购自广州吉妮欧公司。
2.试剂与仪器:亚砷酸钠(NaAsO2,分析纯)购自北京化学试剂三厂;
胎牛血清购自美国Sigma公司;
MEM低糖培养基购自美国HyClone公司;
0.25%胰蛋白酶、青链霉素混合液、谷氨酰胺、PBS缓冲液购自美国HyClone公司;
RIPA裂解液、细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒购自北京索莱宝公司;
兔抗小鼠Nrf2单克隆抗体购自中国万类生物公司、兔抗小鼠HO-1单克隆抗体购自英国Abcam公司、兔抗小鼠Keap1单克隆抗体购自中国万类生物公司;
Anti-rabbit IgG-HRP购自美国CST公司Revert Aid First Strand cDNA Synthesis Kit、QuantiNova SYBR Green PCR Kit购自日本TaKaRa公司;
高速离心机购自美国Sigma公司;
电泳仪购自美国Bio-Rad公司;
化学发光凝胶成像仪购自美国Protein Simple公司;
三色预染Marker、PCR仪购自美国Thermo Fisher Scientific公司。
3.细胞培养及分组:NE-4C细胞用含10%胎牛血清的MEM(含10%FBS、1%青霉素-链霉素、1%谷氨酰胺)于37℃、5% CO2条件下培养,隔天换液,用0.5%胰蛋白酶消化,传代培养。取对数生长期细胞开展后续实验。药物干预时间按照参考文献及预实验结果确定干预时长为48h。实验分组按照亚砷酸钠干预细胞48h的IC50=1.608μmol/L分为0(对照组)、0.4、0.8、1.6、2.4、3.2μmol/L组。
4.CCK-8检测亚砷酸钠对NE-4C细胞活力的影响:从培养箱中取出处于对数生长期的细胞(NE-4C细胞密度达到80%~90%),胰酶消化、离心、吸弃上清后,加1ml完全培养基,吹打混匀制备成细胞悬液,根据细胞计数结果,吸取一定量的细胞悬液进行稀释并将悬液吸取100μl接种至96孔板中,每孔个数为3×103,每组设置3个复孔,放入37℃培养箱过夜,第2天早上吸弃上清,加入不同浓度的亚砷酸钠溶液,连续培养48h后,每孔加入10μl的CCK-8试剂,37℃培养箱中培养1~2h后,酶标仪测定450nm吸光度值。
5.Western blot法检测Nrf2、Keap1、HO-1蛋白表达:染毒结束后,收集细胞于冰上裂解30min。4℃、12000r/min离心10min,取上清进行BCA 蛋白定量。蛋白变性后取20~30μg进行上样,电泳、转膜,5%的脱脂奶粉封闭2h,一抗4℃孵育过夜,1×TBST洗膜3次,每次10min,二抗室温孵育1h,洗膜3次后进行显影,采用Image J进行灰度值分析。
6.qRT-PCR检测Hippo信号通路相关分子mRNA表达:染毒结束后,利用Trizol法提取细胞总RNA,并测定样品的浓度和纯度。根据反转录试剂盒说明书以总RNA为模板反转录合成cDNA,利用Primer-Blast软件设计针对 MST1、SAV1、MOB1、LATS1、YAP的荧光定量PCR引物并合成(生工生物工程股份有限公司),引物序列详见表1。根据荧光定量试剂盒说明书建立荧光定量PCR反应体系,采用2-ΔΔCt值表示mRNA的相对表达量。

表1 实验中所使用mRNA引物序列
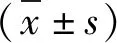
1.亚砷酸钠对NE-4C细胞凋亡的影响:不同浓度亚砷酸钠干预NE-4C细胞48h后,CCK-8结果显示,与对照组比较,0.2和0.4μmol/L组细胞活力高于对照组,但差异无统计学意义;
0.6~1.0μmol/L亚砷酸钠染毒的细胞活力呈逐渐下降趋势,但差异无统计学意义(P>0.05);
1.5~4.0μmol/L亚砷酸钠染毒的细胞活力明显下降,差异有统计学意义(P<0.05,表2,图1)。

表2 亚砷酸钠对NE-4C细胞活力的影响

图1 亚砷酸钠对NE-4C细胞活力的影响A.细胞活力柱状图;
B.细胞活力曲线图。与0μmol/L比较,*P<0.05
2.亚砷酸钠对NE-4C细胞Nrf2、Keap1、HO-1蛋白表达的影响:不同浓度亚砷酸钠干预NE-4C细胞48h后,Western blot法检测结果显示,与对照组比较,0.8、1.6、2.4、3.2μmol/L组HO-1蛋白表达水平升高,差异有统计学意义(P<0.05);
与对照组比较,2.4、3.2μmol/L组Nrf2蛋白表达水平升高,差异有统计学意义(P<0.05);
与对照组比较,1.6、2.4、3.2μmol/L组Keap1蛋白表达水平下降,差异有统计学意义(P<0.05)。结果详见表3和图2。

表3 亚砷酸钠对NE-4C细胞氧化应激相关蛋白表达的影响

图2 亚砷酸钠对NE-4C细胞氧化应激相关蛋白表达的影响A.免疫蛋白印迹法结果;
B.蛋白表达水平柱状图。与0μmol/L组比较,*P<0.05,**P<0.01,***P<0.001
3.亚砷酸钠对NE-4C细胞Hippo信号通路核心分子mRNA表达的影响:不同浓度亚砷酸钠干预NE-4C细胞48h后,RT-PCR结果显示,与对照组比较,2.4、3.2μmol/L组MST1mRNA表达水平升高,差异有统计学意义(P<0.05);
与对照组比较,1.6、2.4、3.2μmol/L组MOB1mRNA表达水平升高,差异有统计学意义(P<0.05);
与对照组比较,1.6、2.4、3.2μmol/L组SAV1mRNA表达水平升高,差异有统计学意义(P<0.05);
与对照组比较,2.4、3.2μmol/L组LATS1mRNA表达水平升高,差异有统计学意义(P<0.05);
与对照组比较,1.6、2.4、3.2μmol/L组YAPmRNA表达水平升高,差异有统计学意义(P<0.05,表4,图3)。

表4 亚砷酸钠对NE-4C细胞Hippo信号通路核心分子mRNA表达的影响

图3 亚砷酸钠对NE-4C细胞Hippo信号通路核心分子mRNA表达的影响与0μmol/L组比较,*P<0.05,**P<0.01,***P<0.001
砷及其化合物具有明显的神经发育毒性,研究证明砷通过诱导凋亡、自噬、坏死等引发神经细胞死亡。有研究认为,极低剂量砷对人体有益,如刺激造血、促进细胞增殖等。本研究结果显示,极低剂量(0.2μmol/L)砷可促进细胞的增殖,而随着亚砷酸钠浓度的增加活力降低,抑制了细胞增殖。长期接触砷对机体中枢及外周神经系统造成不同程度的损害,进而影响机体某些神经行为功能、子代的神经发育和调节系统等[4]。目前,氧化应激被认为是砷致神经细胞毒性损伤的重要机制之一,其受控于诸多因素调节,如信号通路、酶活性等,但具体机制尚不明确。正常情况下,机体处于氧化-抗氧化的动态平衡状态,当遭受某种有害刺激时,细胞及机体内高活性分子如活性氧自由基(reactive oxygen species, ROS)和活性氮自由基(reactive nitrogen species,RNS)产生过多,氧化程度超出机体的清除能力,氧化系统和抗氧化系统的动态平衡被打破,从而导致细胞损伤[11]。
本研究结果显示,亚砷酸钠干预染毒可以诱导NE-4C细胞内ROS产生,提示亚砷酸钠可引起细胞产生氧化应激,而氧化应激可激活细胞内抗氧化系统。抗氧化反应多表现为清除ROS和修复受损细胞的生物分子。Nrf2作为细胞抗氧化系统中的核转录因子,被Kelch样ECH联合蛋白1(recombinant Kelch like ECH associated protein 1,Keap1)锚定在细胞质而被蛋白酶体降解,Keap1作为Nrf2活性的抑制剂,在Nrf2活性的调控中起着关键作用[12,13]。此外,Keap1也是氧化应激的“传感器”。在发生氧化应激后,Nrf2与Keap1分离后进入细胞核,激活下游相关靶基因,如血红素加氧酶1(heme oxygenase-1,HO-1),同时与小Maf(small Maf proteins,sMafs)蛋白结合成异二聚体,然后结合抗氧化反应元件(antioxidant response element,ARE),以此来激活下游相关分子的基因转录,增强细胞的解毒及抗氧化能力,维持细胞氧化还原状态的动态平衡[13]。
HO-1蛋白作为热休克蛋白中的一种,在正常组织中几乎不表达,当细胞受到氧化应激时,HO-1大量产生以提高机体的抗氧化水平,减少机体对氧化应激的敏感度,维持机体正常生存并减少细胞凋亡的发生[14]。Abiko等[15]将肝癌细胞暴露于砷中,结果显示,HO-1可被持续激活并伴随Nrf2激活时间延长,而HO-1基因敲除可降低Nrf2激活时间。同时使用HO-1抑制剂预处理可增强砷暴露诱导的细胞毒性作用,表明HO-1可能是Nrf2激活的正反馈调节因子。Reichard等[16]研究认为,砷不仅会引起Nrf2的激活而且也会引起HO-1转录抑制因子Bach1的失活,因此当细胞暴露于砷环境时,会出现HO-1的持续激活。本研究结果显示,不同浓度亚砷酸钠作用于NE-4C细胞后,Nrf2、HO-1蛋白表达随亚砷酸钠浓度的增加而升高,Keap1蛋白的表达随亚砷酸钠浓度的增加而降低,提示亚砷酸钠激活了NE-4C细胞抗氧化系统中Nrf2通路以抵抗氧化应激损伤。
细胞的增殖、凋亡并不是受单一信号通路调控。Hippo 通路中的相关分子或激酶也通过促进或抑制细胞内很多其他信号通路来发挥其相应的作用,共同调节着机体正常的生命活动。哺乳动物Hippo信号通路的核心是一个激酶级联,其高度保守且通过调控细胞增殖或凋亡来决定器官大小,在生长发育和维持组织稳态等方面发挥关键作用[17]。在此通路中,上游信号活化哺乳动物 STE20 激酶(mammalian STE20-like protein kinase 1/2,MST1/2)后,与Salvador同系物1(Salvador homolog 1,SAV1)蛋白结合成复合物,继而磷酸化下游激酶肿瘤抑制基因1/2(large tumour suppressor 1/2,LATS1/2),活化的LAST1/2与Mps结合激酶激活物1(Mps once binder kinase activator-like 1,MOB1)相结合磷酸化下游核心效应分子Yes相关蛋白(Yes-associated protein,YAP)及其旁系同源分子,YAP无法与DNA直接结合,必须与TEA结构域家族转录因子(transcriptional enhancer associate domain family members,TEAD)等转录因子相互作用才能介导下游靶基因的表达调控。阻断Hippo信号通路或该通路核心成员缺失将导致YAP入核增加,与转录因子TEAD等结合并诱导与细胞增殖、存活和迁移有关的一系列基因的表达[18,19]。
本研究结果显示,与对照组比较,不同浓度亚砷酸钠干预NE-4C细胞48h后,Hippo信号通路关键分子MST1、MOB1、SAV1、YAP mRNA表达水平随亚砷酸钠浓度的增加而升高。LATS mRNA表达水平随亚砷酸钠浓度的升高呈现先降低后升高的趋势。表明亚砷酸钠可激活Hippo信号通路。而经典的Hippo信号通路激活之后,YAP入核减少从而降低其表达,与本研究结果显示YAP mRNA表达增加不一致。以上情况可能跟NE-4C细胞缺少p53基因有关。有研究发现,在p53缺失的小鼠自发性淋巴瘤中通常表现出YAP的上调,而YAP的变化与MST1的活性无关。这似乎证明p53的缺失和YAP的联合上调是通过一种未知的机制获得了一种选择性优势[20]。Li等[21]研究发现,砷可诱导染砷小鼠皮肤Hippo信号通路核心分子蛋白表达增加,且砷可独立于Hippo信号通路来激活YAP。这与本研究结果相一致,因此本研究认为,亚砷酸钠可以激活Hippo信号通路,同时也独立于Hippo信号通路激活YAP,其具体激活机制还有待于深入研究。
综上所述,本研究发现亚砷酸钠可抑制NE-4C细胞增殖,诱导细胞抗氧化分子Nrf2通路激活以抵抗氧化应激;
同时亚砷酸钠可诱导Hippo信号通路激活,且可独立于Hippo信号通路激活YAP,但其具体激活机制尚需开展进一步研究予以证实。