古力加乃提·麦麦吐逊 严伟 麦路德木·麦麦吐逊 蒋海山
Susac综合征(Susac syndrome,SS)又名脑、视网膜、耳蜗微血管病[1],典型的临床三联征为“急性脑病、视网膜分支动脉闭塞(branch retinal artery occlusion, BRAO)和听觉受损”[2]。该病各系统受累症状出现前后顺序不固定,早期神经系统症状可不典型,很容易误诊。本文报告1例眼科症状首发Susac综合征患者5年诊治过程,并通过文献复习,分析了本病误诊原因,诊断方法及临床转归。
患者,男,29岁,“突发言语不清,右侧肢体无力8 h” 于2017年5月5日收住神经内科。患者于2016年7月因“双眼视力下降、复视、头痛”就诊我院眼科,诊断为“双眼视网膜脉络膜炎”,经过糖皮质激素治疗,症状改善,出院后自行停药。随后分别于2016年8月及2017年2月再次因视物模糊收住眼科,治疗效果不佳。患者晨起时出现右侧肢体无力,右上肢可上举过肩,右下肢拖拽行走,伴言语不清,注意力不集中。患者否认类似疾病家族史。
体格检查:心肺腹未见明显异常。神经系统查体:神志清,定向力、判断力可,计算力减退。双侧瞳孔等大等圆,直接与间接对光反射灵敏,视力右眼0.5,左眼0.3;
右侧鼻唇沟变浅,双侧听力粗测正常,构音不清,咽反射弱,伸舌偏右。四肢无肌萎缩,肌张力正常,右侧肢体肌力4级,左侧肢体肌力5级。感觉正常,右侧Babinski征(+),脑膜刺激征(-)。简易精神状态检查量表(mini-mental state examination,MMSE)评分17分(大学本科学历);
汉密尔顿焦虑量表20分,抑郁量表18分,提示中度焦虑,轻度抑郁。
血、尿、便常规、生化、自身免疫相关抗体(狼疮四项、抗心磷脂抗体、血管炎五项)无异常,梅毒、HIV抗体均阴性。头颅MRI平扫:脑内多发陈旧性脑梗死;
胼胝体体部雪球样异常信号(图1);
桥脑左侧急性期脑梗死。眼底造影:早期双眼视网膜后极部毛细血管迂曲扩张,视网膜后极部可见高荧光,晚期荧光渗漏(图2)。电测听:右耳气导20~40 db,骨导20~40 db;
左耳气导20~30 db,骨导20~30 db。
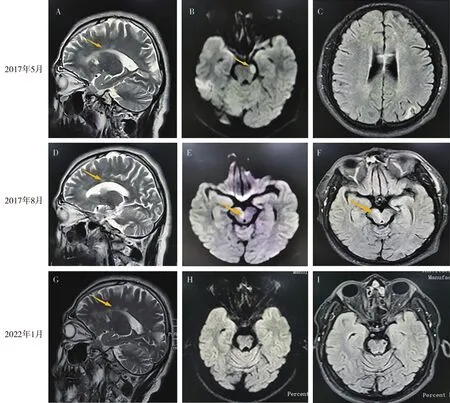
图1 不同时期头颅MR A,矢状位T2WI序列示胼胝体高信号病变,呈特征性雪球样改变;
B,DWI桥脑左侧斑片状高信号;
C,横断面T2WI/FLAIR序列示胼胝体高信号病变;
D,矢状位T2WI序列示胼胝体高信号病变;
E,DWI桥脑右侧斑片状高信号;
F,FLAIR桥脑斑片状高信号;
G,矢状位T2WI序列示胼胝体高信号病变;
H、I,未见新发病灶。

图2 发病时及随访期间的眼底造影 A,造影早期双眼视网膜后极部毛细血管迂曲,扩张,视网膜后极部可见数个点状高荧光,晚期荧光渗漏;
B,造影早期双眼视网膜后极部毛细血管迂曲,扩张,视网膜后极部可见数个点状高荧光,较前减轻。
定位诊断:临床表现为突发言语不清、视力减退、右侧肢体无力,近期有渐进性记忆力减退,查体提示视力减退、右侧中枢性面舌瘫及锥体束征,头颅MRI提示颅内多发陈旧性腔隙性梗死,胼胝体体部雪球样异常信号,桥脑左侧急性期脑梗死。综合定位于左侧锥体束传导径路以及胼胝体。
定性诊断:急性起病,部位多发,影像学提示桥脑左侧新发病灶,定性考虑血管性、炎性、感染性、脱髓鞘性等可能,结合患者发病部位呈多系统受累,此前有类似发作,经过免疫治疗好转,综合定性炎性,尤其是血管炎性可能性大。
综合诊断:结合患者头颅MRI提示胼胝体体部雪球样异常信号(为susac综合征特征性改变),眼底荧光造影示视网膜后极部可见高荧光,晚期荧光渗漏;
听力五项提示低频感音性耳聋;
根据欧州Susac协会(European Susac Consortium)2016年12月发表的Susac综合征诊断标准[3],最后确诊Susac综合征。需与其他累及胼胝体的遗传性及获得性因素鉴别,如获得性因素包括淋巴瘤、胶质瘤、免疫性脱髓鞘、感染等,遗传性因素包括遗传性弥漫性白质脑病并轴索球样变(HDLS)、白质消融性白质脑病(VWM)、成人起病的常染色体显性遗传性脑白质营养不良(ADLD)等。
口服醋酸泼尼松70 mg/d(1 mg/kg),5 d后序贯减量;
阿司匹林肠溶片100 mg,每日1次口服。复视、言语不清症状好转,出院后自行停药。于2017年8月再次出现左侧肢体无力、言语不清住院(图3)。头颅MR提示:中脑急性期脑梗死(图1),考虑Susac综合征复发,给予醋酸泼尼松同时加用环磷酰胺口服100 mg/d(2 mg/kg),1周后复视症状改善出院。跟踪随访5年后(2022年1月),认知功能(MMSE:26分)、情绪改变(汉密尔顿焦虑量表7分、抑郁量表9分)较前恢复,听力障碍、神经功能缺损症状未进展,仍遗留视物不清、言语缓慢后遗症。头颅MR:颅内多发陈旧性脑梗死(图1)。

图3 随时间出现的临床表现
SS病因及发病机制可能与免疫、血管痉挛、凝血功能障碍和病毒感染有关[4]。MAGRO等[5]和GROSS等[6]研究证实SS患者血清中存在抗内皮细胞抗体,CD8 T细胞对内皮细胞抗原产生反应,导致内皮细胞损伤,引起小缺血灶和微出血灶可能是SS的发病原因。应用免疫抑制剂及免疫调节剂治疗对SS有效[7]。
SS多为急性或亚急性起病[3],依靠临床表现、头颅MRI、眼底造影及听力检测等信息综合诊断。SS三联征中,脑病表现为头痛、认知、精神行为异常,可伴有其他局灶神经系统症状体征[8]等;
BRAO表现为视力下降,伴不同程度的视野缺损,眼底检查可见视网膜缺血性苍白、棉絮斑样渗出点,累及眼后部,可见特征性的Gass斑[4]。眼底荧光造影诊断价值高,可显示BRAO或动脉壁高荧光及渗漏。听力障碍多为耳鸣、眩晕,由耳蜗顶端小血管梗死所致,听力检查多呈现感应性耳聋。头颅MRI为首选的神经影像学检测手段,典型的MRI图像表现为胼胝体、基底节区、脑干广泛多发性小灶,幕上幕下均可受累。胼胝体损害时,呈“雪球样”改变[4]。但是在SS发病初期上述典型的三联征可不同时出现。
患者首发视力下降而反复就诊眼科,神经系统症状不典型。当突发神经系统症状时,头颅MRI发现胼胝体“雪球样”改变,在排除心源性或动脉粥样硬化所致栓塞后,眼底荧光造影发现视网膜后极部点状高荧光,晚期荧光渗漏,听力五项提示低频感应性耳聋,诊断SS。同时,免疫抑制剂治疗后症状好转,自行停药后症状再次加重,也证实Susac综合征诊断[7]。
因SS为罕见病,临床表现多样,误诊率高,与该患者类似的眼科症状首发的病例作出正确的诊断是治疗核心环节。视网膜血管荧光渗漏对我们的诊断有重要价值,因此需要鉴别其他可伴有视网膜血管荧光渗漏的神经系统疾病,经文献回顾可知,伴有视网膜血管荧光渗漏的神经系统疾病谱见表1。

表1 伴有视网膜血管荧光渗漏的神经系统疾病谱
目前SS治疗方法有糖皮质激素、免疫球蛋白,免疫抑制剂、血浆置换、抗血小板聚集等。2020年Susac综合征治疗指南[7],根据神经系统受累程度(脑部症状和MRI提示的新病灶)确定给药方案及剂量:糖皮质激素(甲强龙)1000 mg 静脉给药3~7 d,然后强的松1 mg/(kg·d)(最大剂量80 mg)逐渐减量,如病情复发加用免疫抑制剂或免疫球蛋白联合环磷酰胺。该患者口服糖皮质激素后复发,予环磷酰胺后趋于稳定,更加支持该病是自身免疫性血管内皮细胞病。
该病例展现了与大部分SS患者类似的波动性单向病程,预后与损害的严重程度密切相关,可遗留不同程度的后遗症。一般多系统、多脏器受累疾病以单个主诉发病时,临床上专科医生常常误诊误治,延误病情,主要原因可能:①对疾病认识不足;
②受思维定势的影响,满足于常见病、多发病的诊断,较少考虑其他诊断;
③没有进行全面的体格检查,或者患者症状不典型。为避免误诊误治,临床医师应理清思路,首先要认真询问获取病史,全面体格检查,完善必要的辅助检查,及时安排会诊及讨论。与本病例相似的眼科初诊的SS患者,根据临床表现、体征及眼底检查中的异常信息,如考虑到伴发神经系统疾病的可能性,或许可以早期诊断SS,疾病初期开始治疗,得到更好的预后。