任章勇,吕少诚,王芳菲,赵昕,郎韧,贺强
(首都医科大学附属北京朝阳医院肝胆外科,北京 100020)
随着外科手术器械的改良以及手术技术的提高,血管重建技术在外科手术中的应用越来越广泛[1-4]。目前在血管重建中应用的血管移植物有自体静脉、自体壁层腹膜/镰状韧带、人工血管及同种异体血管等[5]。迄今为止,自体血管仍然被认为是血管重建中最佳的血管移植物,但其来源有限,且在较大的血管重建中难以获得合适的自体血管。人工血管来源广泛,但术后需长期应用抗凝药,增加患者经济负担及出血风险,长期通畅率仍有待提高。同种异体血管具有来源丰富、管径易匹配、组织相容性好、近远期通畅率高等优点,是临床工作中较常选用的静脉移植物[6-8]。但同种异体血管作为异源性血管移植物,术后可能会在特异和非特异炎症反应的共同作用下导致附壁血栓形成、内膜增生及瘢痕形成[5]。因此,研究同种异体血管置换术后具体病理改变及相应机制具有重大意义。由于临床中同种异体血管置换术后病理标本获取困难,大鼠下腔静脉置换模型的建立能为同种异体血管置换后相关病理改变的研究提供模型基础。目前关于静脉移植的实验动物模型报道相对较少,有文章报道[9]可通过双袖套技术构建大鼠静脉置换模型,但其术后会将聚乙烯套管遗留受体鼠体内,其引发机体非特异性炎症是否会对静脉移植后相关病理改变的研究造成干扰尚不明确,本文通过评估“套管法”和“吻合法”两种大鼠下腔静脉移植模型各自优劣势,寻找安全有效的大鼠下腔静脉移植模型的建立方法,为后续静脉置换术后相关病理改变的研究提供模型基础。
1.1 材料
1.1.1 实验动物
72只6周龄SPF级雄性Brown-Norway(BN)大鼠,体重为180 ~ 200 g,购自北京维通利华实验动物有限公司【SCXK(京)2021-0006】。饲养环境:在恒定温度、湿度和光暗循环(20 ~ 25℃,55% ± 10%,7:00 ~ 19:00光照循环)下自由饮水和摄食,饲养于首都医科大学附属北京朝阳医院医学研究中心【SYXK(京)2020-0005】。所有操作符合实验动物福利伦理原则,并获得首都医科大学动物实验及实验动物福利委员会的批准(AEEI-2021-147)。
1.1.2 主要试剂与仪器
动物用异氟烷(深圳市瑞沃德生命科技有限公司,中国),Anti-CD4 antibody (Abcam, ab237722,英国),RNA提取液(Servicebio,G3013,中国),SweScriptRTI First Strand cDNA Synthesis Kit(Servicebio,G3330,中国),2 × SYBR Green qPCR Master Mix(None ROX)(Servicebio,G3320,中国)。
双目外科显微镜(OLYMPUS,SZX16,日本),动物手术LED光纤灯(OLYMPUS,LG-PS2,日本),小动物麻醉机(SURGIVET,CDS 9000,美国),外科手术器械包(深圳市瑞沃德生命科技有限公司,SP0011-B MCAO,中国),正置光学显微镜(尼康,Nikon Eclipse E100,日本),小动物超声仪(VisualSonics,Vevo 2100,加拿大),荧光定量PCR仪(Bio-Rad,CFX Connect,美国),超微量分光光度计(Thermo,NanoDrop 2000,美国)。
1.2 方法
1.2.1 实验分组
随机分为2组,每组18只。套管组:采用套管法构建下腔静脉置换模型;吻合组:采用缝合法直接吻合供受体静脉断端,构建下腔静脉置换模型。
1.2.2 供体静脉的获取
选取36只BN大鼠作为供体大鼠,采用1%异氟烷吸入麻醉后固定于大鼠手术台,胸腹部备皮、碘伏消毒,铺无菌洞巾。于剑突下作2 cm长的切口入腹,剪断肝上下腔静脉放血处死大鼠。左右两侧距前正中线1.5 cm剪开肋骨,将前胸壁上翻,暴露胸内下腔静脉,去除静脉周围的脂肪组织,于右心房与膈肌间剪下约6 ~ 7 mm长的静脉段,以肝素生理盐水冲去周围血渍后置于4℃的肝素生理盐水中(如图1A),可直接作为吻合组的供体血管;将取下的静脉段从一长5 ~ 6 mm的薄壁塑料管中穿出,两端反折套与塑料管上,形成静脉套管(如图1B),作为套管组的供体血管。
图1 供体静脉Note. A. Donor vein segments for “anastomosis method”. B. Donor vein cannula for “cannula method”.Figure 1 Donor vein
1.2.3 “吻合法”构建大鼠下腔静脉置换模型
18只BN大鼠作为受体大鼠,随机种子数法分为1周组、2周组和4周组,每组各6只。所有大鼠腹部备皮,碘伏消毒后铺无菌孔巾;取剑突下1 cm至尿道上方1 cm处纵行切口入腹,用腹腔牵拉器向两侧拉开腹腔充分暴露术野,盐水纱布包裹肠管并将其推向腹腔左侧,使用棉签钝性分离后腹膜显露腹主动脉及下腔静脉;游离肾静脉下方的下腔静脉至左、右侧腰静脉之间的下腔静脉,结扎离断其周围的属支;于游离段下腔静脉两端以显微血管夹阻断后剪断,以肝素生理盐水冲去周围血渍,根据供体静脉段长度修剪过长的受体静脉断端;于受体静脉和供体静脉3点钟和9点钟方位各缝合一针作为牵引固定线;采用连续缝合法吻合静脉前壁;翻转动脉夹和牵引线,使静脉前后壁翻转,采用间断缝合法缝合静脉后壁;同法吻合第2个吻合口,最后几针时向静脉管腔内注射肝素生理盐水排出静脉腔内空气,预防气体栓塞;先开放静脉近心端血管夹,检查有无漏血,止血确切后再开放远心端血管夹,无活动性出血、血管通畅性良好后,以温生理盐水冲洗腹腔,逐层关腹,手术过程见图2A,2B,2C。
1.2.4 “套管法”构建大鼠下腔静脉置换模型
选取18只BN大鼠作为受体大鼠,随机种子数法分为1周组、2周组和4周组,每组6只。受体大鼠的准备及下腔静脉的游离等步骤同吻合法。由于血管夹具有较大的空间占位而不利于静脉套管的植入,可用丝线系活结替代血管夹用于阻断血流。依次阻断左、右侧腰静脉、远端下腔静脉(左右腰静脉以下)、近端下腔静脉;于游离段静脉中间横向剪开约2/3周径的切口,以肝素生理盐水冲去周围血渍;用无损伤镊子提起静脉切缘,将供体静脉套管一端塞进受体下腔静脉;提起受体静脉另一端切缘,再将静脉套管另一端放进受体静脉内,完全放入前以肝素生理盐水排出静脉套管及受体静脉腔内空气,调节供体静脉套至合适位置后以6-0丝线环扎固定;将未剪断的1/3受体静脉壁完全离断,修剪赘余的受体静脉壁,松开各活结开放静脉;检查无活动性出血、血管通畅性良好后,以温生理盐水冲洗腹腔,逐层关腹,手术过程见图2D,2E,2F。
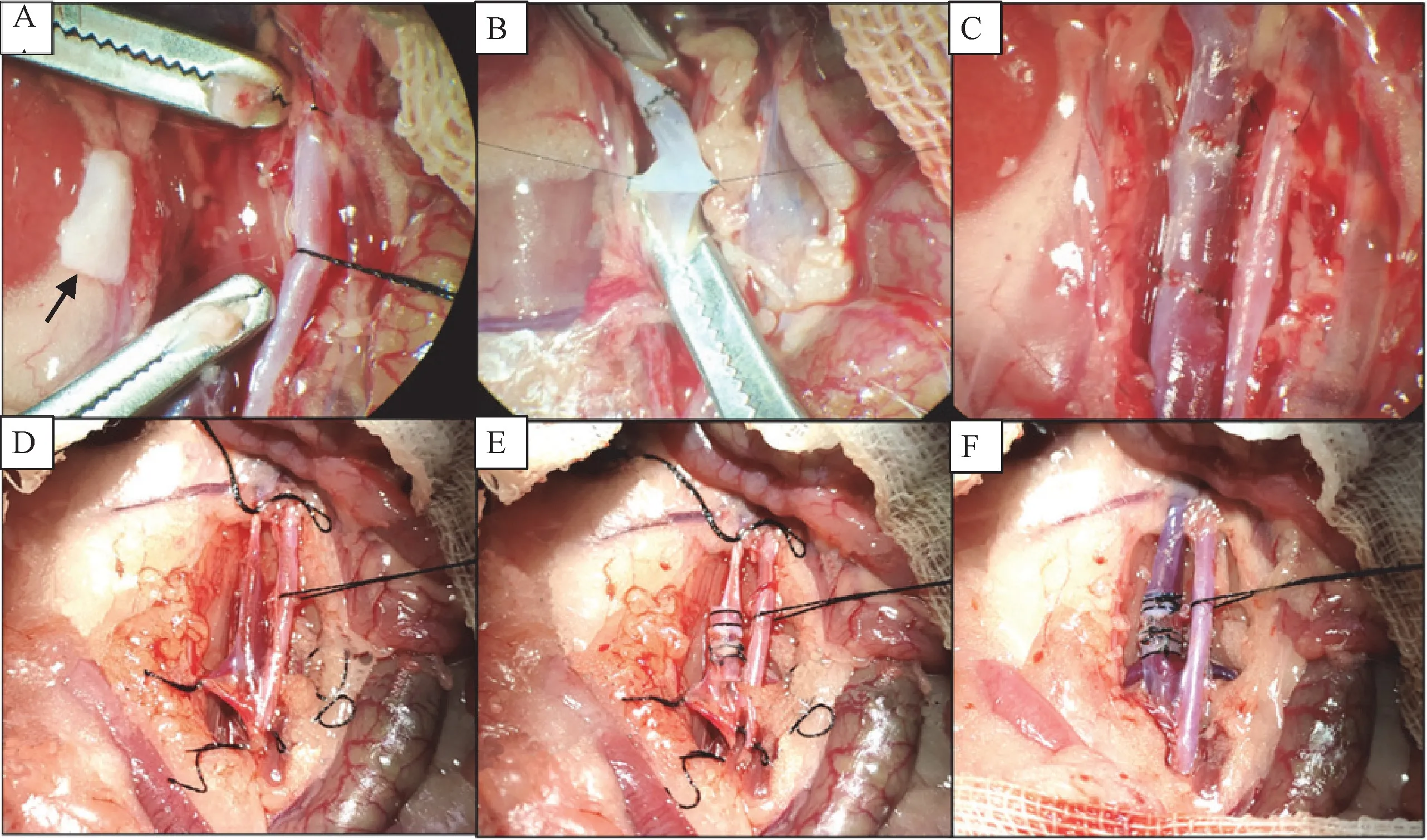
图2 血管置换手术过程Note. A. The donor vein segment is trimmed according to the tension at both ends of the recipient vein (shown by the black arrow in the figure). B. The upper and lower anastomoses are sutured successively by the continuous anterior wall and interrupted posterior wall method. C. The blood flow is opened after the suture is completed and there is no blood leakage. D. Freeze the recipient infrarenal inferior vena cava and block the left and right lumbar veins, distal inferior vena cava and proximal inferior vena cava in turn with a silk thread tie. E. Transversely cut the venous wall at 2/3 circumference in the middle of the recipient vein and insert one end of the donor venous cannula into the recipient vein from the incision. F. Completely insert the donor venous cannula and open the blood flow after checking that there is no blood leakage.Figure 2 Procedure of vascular replacement
1.2.5 术后观察
手术完成后置于38.5℃复温台上复温至苏醒,移至单笼饲养。术后24 h内以浓度为5%的葡萄糖溶液喂食,24 h后恢复正常喂食。术后48 h存活、无后肢瘫痪等并发症发生时定义为建模成功。
1.2.6 术后置换段血管通畅性评估
术后大鼠每隔1周做1次腹部血管超声。大鼠腹部剃毛,用1%异氟烷吸入麻醉后将大鼠固定于操作台。使用小动物超声影像系统对其进行成像,脉冲重复频率设置为2.2 ~ 3.3 kHz,以肾下下腔静脉作为标记找到置换段静脉,以16 ~ 30 Hz的帧频获得二维和彩色多普勒图像及流速变化情况。
1.2.7 组织学检测
各组大鼠术后到达观察时间后,经麻醉后开腹探查获取置换段组织,下腔静脉放血处死。测量置换段血管管径后将其分为两段,一段置于10%福尔马林中固定48 h,脱水后浸蜡包埋组织标本块,4 μm切片,并行HE染色、CD4免疫组化染色。另一块标本立即转移至液氮保存,并进行TGF-β1的RT-PCR相对定量检测。
引物信息:TGF-β1 primer:F:5’-ATAGCAACAA TTCCTGGCGTTACCTT-3’;R:5’-CCTGTATTCCGT CTCCTTGGTTCAG-3’。
1.3 统计学分析
所有检测数据进行汇总后采用SPSS 19.0统计软件进行统计学分析,计量资料符合正态分布采用平均值 ± 标准差(±s)示,非正态分布采用中位数(四分位间距)表示;计数资料采用百分率表示。两组计量资料之间比较,符合正态分布采用t检验,非正态分布采用秩和检验;两组计数资料之间的比较χ2检验。P< 0.05为差异具有显著性。
2.1 模型成功率、手术时间及血流阻断时间
套管法和吻合法各建立静脉模型18只,套管法术后48 h内成功率为100.0%(18/18),吻合法术后死亡1只,死亡原因为术中失血过多,术后48 h内成功率为94.4%(17/18),两组存活率差异无显著性(P= 0.310)。如图3所示,套管组手术时间及血流阻断时间均较吻合组短[(35.8 ± 3.6) min vs (56.8 ± 4.9) min;(35.8 ± 3.6) min vs (56.8 ± 4.9) min],差异均具有显著性。

图3 两种模型建立方法的手术时间和血流阻断时间Note. Group comparison, *P < 0.05. (The same in the following figures)Figure 3 Operation time and blood flow blocking time of the two model establishment methods
2.2 术后不同时间各组移植段血管通畅情况
如图4所示,两组术后4周内置换段血管均通畅,未见血管闭塞及血栓形成。由图5可见,术后1周时,套管法及吻合法的移植段血管血流速度均有所增高,套管法增加更为明显。随着术后时间的延长,套管法模型中移植段血管流速逐渐减低,而吻合法模型中移植段血管先于2周时降低,4周时逐渐升高。

图4 腹部血管彩色多普勒Figure 4 Color Doppler of abdominal blood vessels

图5 术后两组置换段血管血流速度比较Figure 5 Comparison of blood flow velocity of replacement segment between the two groups after operation
2.3 术后不同时间各组移植段血管直径变化
如图6所示,套管组1周后,移植段血管周围轻度粘连,可见周围组织充血等改变,未见明显静脉侧枝形成,移植段血管通畅,未见明显血栓形成,管壁外可见纤维性渗出。套管组4周后,移植段血管可见明显静脉侧枝形成,移植段血管管壁外形成纤维包壳,移植段血管管壁变厚,管径变细,但血管腔通畅。吻合法1周后,移植段血管周围未见明显粘连及静脉侧枝,移植段血管通畅,未见血栓形成,管壁正常。吻合法4周后,精索静脉可有增粗改变,但未见其他明显侧枝形成,移植段血管通畅,未见明显血栓,管壁较强有所增厚,管径较前变细。如图7所示,随着术后时间的延长,套管组和吻合法模型的移植段血管管径均逐渐变细,套管组尤为明显,各个时期内,套管组模型的管径均较吻合法小,差异具有显著性。

图6 术后置换段血管周围侧枝形成情况及供体静脉通畅情况Figure 6 Formation of collateral branches around the blood vessels of the replacement segment and the patency of the donor vein after operation
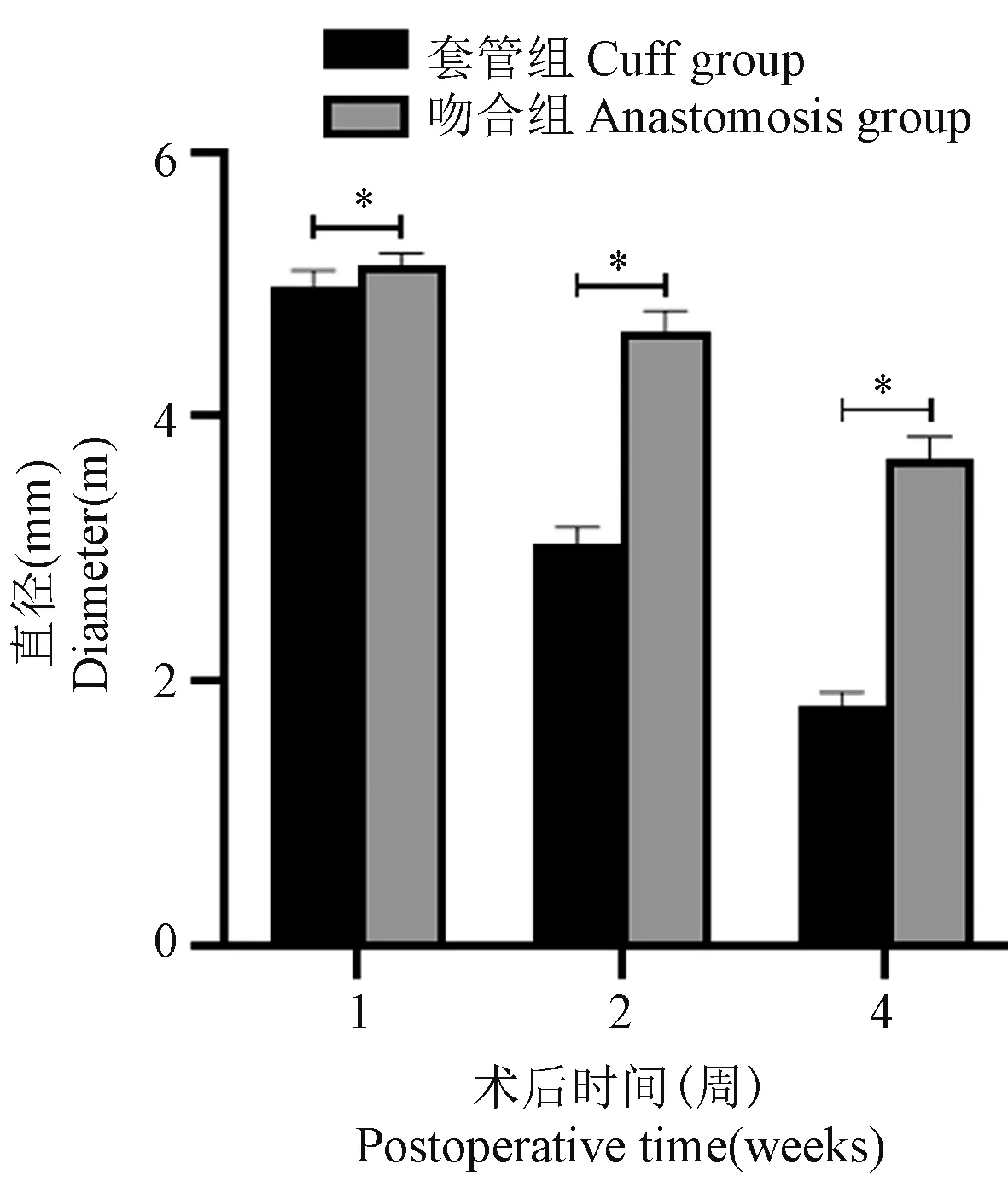
图7 术后两组置换段血管直径比较Figure 7 Comparison of the diameter of the replacement segment between the two groups after operation
2.4 移植段血管病理情况
由图8所示,静脉移植术后1周后,套管组和吻合法模型中均可见淋巴细胞浸润,淋巴细胞主要聚集与外膜层,管壁结构均无明显改变;移植术后2周时,套管组模型中可见肌层增生变厚,管腔较1周时明显变窄,管壁外可见纤维素沉积形成包壳,管壁全层均可见淋巴细胞,吻合法模型中管壁全层可见明显淋巴细胞浸润,管壁各层均未见明显增生,管腔无明显狭窄表现;移植术后4周时,套管组模型组静脉中的内膜层可见增生,肌层增生较前更为明显,管腔较前进一步缩窄,管壁外可见明显纤维包壳形成,吻合法模型中亦可见内膜层及肌层增生,淋巴细胞浸润较2周时有所减少。
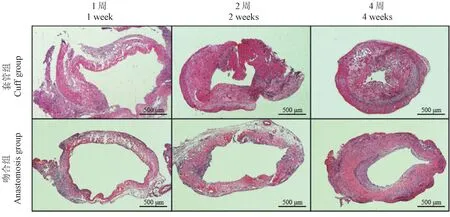
图8 移植段血管HE染色(×50)Figure 8 HE staining of grafted blood vessels(×50)
如图9、10所示,静脉移植术后各阶段均可见CD4+淋巴细胞浸润,1周时套管组和吻合法浸润程度无统计学差异,随着术后时间的延长,套管组模型中CD4+淋巴细胞浸润逐渐减少,而吻合法模型中逐渐增多,术后2周后,吻合法模型中CD4+淋巴细胞浸润较套管组严重,其MOD值的差异具有显著性。

图9 移植段血管CD4免疫组化染色(×200)Figure 9 CD4 immunohistochemical staining of grafted blood vessels(× 200)
2.5 置换段血管中TGF-β1的PCR相对定量检测
套管组和吻合组在不同时间点置换段血管组织中TGF-β1的PCR相对定量结果如图11所示。随着术后时间的延长,两组模型中置换段静脉组织内TGF-β1的表达量均逐渐升高,2周内2组间无统计学意义,4周时,套管组中表达量高于吻合组,差异具有显著性。

图11 术后两组置换段血管组织TGF-β1相对表达量Figure 11 TGF-β1 in vascular tissue of replacement segment in two groups after operation relative expression
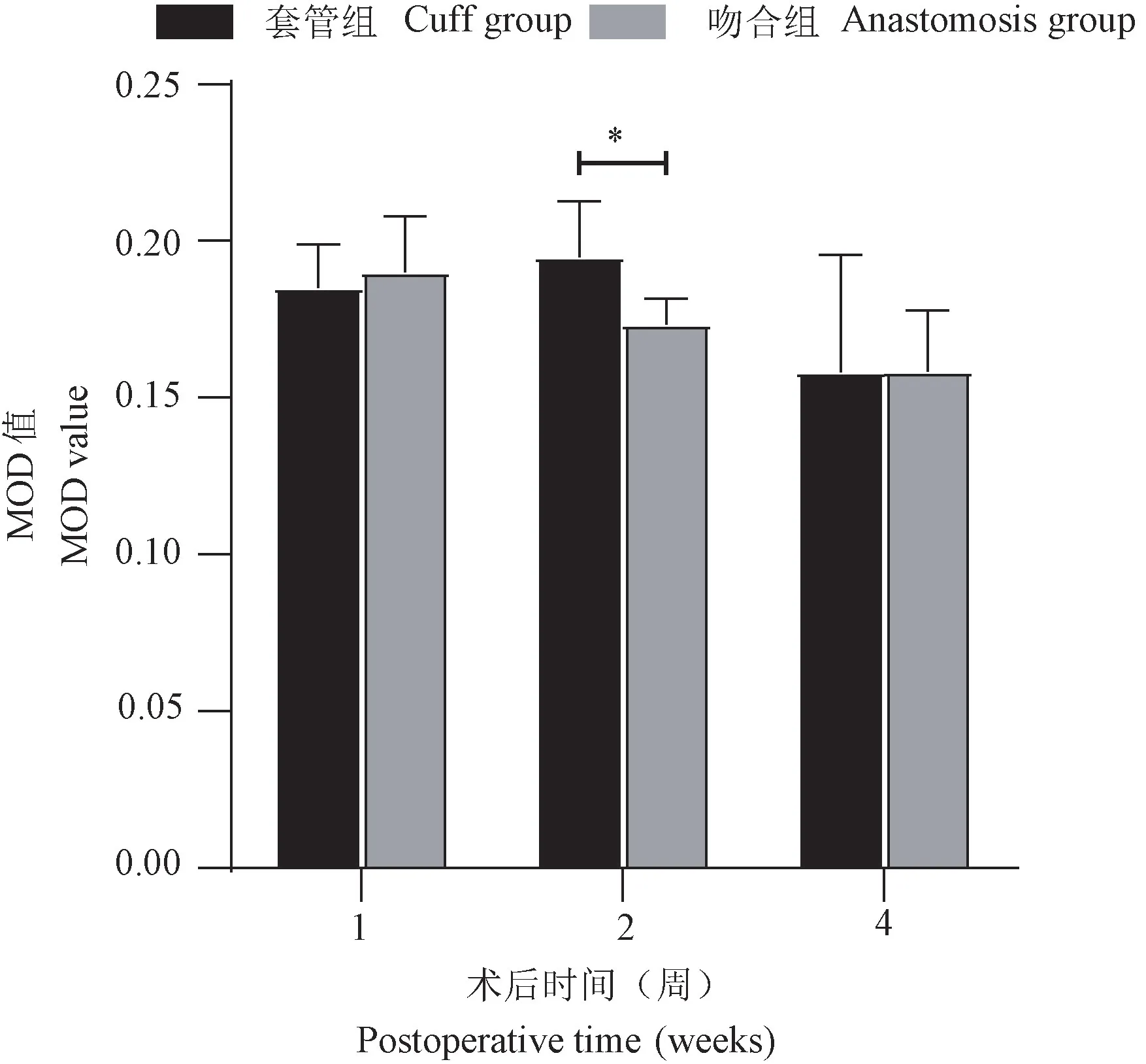
图10 移植段血管CD4免疫组化MOD值比较Figure 10 Comparison of CD4 immunohistochemical MOD values of transplanted blood vessels
当体内重要组织、脏器的血管因意外损伤,或是因疾病侵犯、波及而无法恢复时,通过切除病变血管,用血管移植物重建局部血流是最佳的治疗方案[10-11]。目前血管重建中常用到的血管置换物有自体血管、人造血管及异体血管。自体血管来源有限,增加患者创伤,并受管径大小、取材长短,以及患者自身血管条件的限制,临床应用前景有限[12]。目前应用于临床的人造血管有涤纶、聚四氟乙烯、聚氨酯等,其优点是来源丰富、能批量生产,可根据临床需要制备特殊口径和形状,但其缺点是生物相容性差,血栓形成率高,达不到小血管置换的要求。同种异体血管首先由Debakey等[13]于20世纪50年代应用于临床血管重建,具有来源丰富、管径易匹配、组织相容性好等优点。起初,同种异体血管主要应用于血管严重感染性疾病中受感染血管的置换[14-15]。随着血管获取及储存技术的不断改进,同种异体血管在临床中的应用逐渐普及。
作为一种异体来源的组织,同种异体血管移植后是否会像其他器官移植一样发生移植排斥反应目前尚无明确结论。有报道血管置换后置换段血管内膜增生、管腔狭窄及闭塞使手术的远期失效率高达30% ~ 60%[16-17]。由于临床上术后取材困难,通过建立大鼠腹部血管置换模型,观察其术后置换段血管的病理改变及免疫状态的改变,可为后续关于同种异体血管置换后的病理改变机制及干预措施的研究奠定基础。目前已经开发出了多种血管置换模型,Koulack等[18]报道了用于研究移植物血管病变的主动脉置换模型,其中动脉置换模型的研究相对较多[19-20],Zhang等[21]将供体小鼠的腔静脉移植到受体小鼠的颈动脉循环中,以研究静脉移植后新生内膜的病理改变,然而,动脉与静脉结构层次并非完全一致,管径亦很难匹配,当静脉置换到动脉循环后,管腔在动脉压的作用下逐渐扩张,随着术后时间的延长,静脉壁逐渐重塑变厚以适应动脉循环的高压力,有时血液在连接处形成涡流,纤维蛋白沉着在静脉皱褶上,最终导致闭塞性血栓形成。因此,“静脉到动脉”的置换模型并不能真实地反应静脉置换后的相关病理改变。由于静脉壁薄,缝合较为困难,Yan等[9]通过“双袖带技术”成功建立了小鼠门静脉置换模型。但采用“双袖带技术”构建的静脉置换模型会将聚乙烯套管遗留与受体体内,该套管是否会形成异物反应对静脉置换后相关病理改变的研究造成干扰尚不明确。本实验采用“套管组”和“吻合法”两种静脉重建方式构建大鼠静脉置换模型,通过观察两组模型术后的相关病理改变,评估其各自的优劣势,为后续静脉置换后相关病理改变机制的研究提供安全、稳定的模型基础。
从手术时间来看,吻合法的总手术时间及血流阻断时间均较套管组长,差异具有显著性,但模型成功率方面无明显差异。两组模型大鼠术后4周均能长期存活,置换段血管均未见闭塞,未出现后肢瘫痪等严重并发症。术后腹部血管超声结果与管径变化趋势一致,术后1周时两组流速较前稍有增大,考虑与术后吻合口水肿等因素有关,随着术后时间的延长,套管组流速逐渐降低,与吻合组相比差异具有显著性,术后4周时,吻合组流速较前稍增大,考虑与置换段血管管壁重塑、管腔变窄有关。从术后大体标本来看,随着术后时间的延长,两组模型置换段静脉直径均逐渐缩小,套管组变化更为明显。4周内吻合组未见明显静脉侧枝形成,置换段静脉管壁逐渐增厚,但管腔通畅性良好,而套管组可见置换段静脉周围出现静脉侧枝,置换段静脉管腔缩小,管壁外层可见纤维包壳形成。
从术后置换段静脉组织HE染色来看,套管组术后管壁出现皱缩,肌层增生,外层可见纤维素沉积形成包壳,内层可见内膜增生,进而导致管壁增厚,管腔狭窄,而吻合组静脉管壁各层次尚清晰,管壁亦随着时间的延长逐渐增厚,4周时可见肌层及内膜增生,管腔较前缩小。两组模型术后均可见单个核细胞浸润,吻合组较套管组更为明显,可能是聚乙烯套管产生的非特异炎症或纤维素样物质抑制单个核细胞的浸润有关,具体机制还需进一步研究明确。从CD4免疫组化染色结果来看,两组模型术后均可见静脉壁肌层及外模型中CD4+T淋巴细胞浸润,随着术后时间的延长,套管组中CD4+T淋巴细胞逐渐减少,而吻合组中逐渐增多。
TGF-β1是目前研究已知与机体的瘢痕形成及组织重塑关系最密切的细胞因子,可以由多种细胞分泌产生,可以通过旁分泌、自分泌等多种生物学途径作用于成纤维细胞参与创伤修复过程[22-23]:一方面能直接刺激成纤维细胞,促进其增殖,进而转换为肌成纤维细胞形成瘢痕;另一方面可以使原本处于静止期的成纤维细胞活化,促进胶原基质的形成;还可以抑制胶原基质的分解,导致瘢痕不断积累增加。TGF-β1在组织器官的炎症、损伤、瘢痕以及组织重塑之间起着重要的链接作用[24-25]。本研究当中,两个置换模型组中均可见TGF-β1表达量逐渐升高,4周时套管组表达量高于吻合组,差异具有显著性。
总之,静脉置换术后,静脉壁中可见单个核细胞及CD4+T淋巴细胞浸润,组织中TGF-β1表达量随着术后时间的延长逐渐升高,静脉壁重塑主要表现为肌层及内膜增生,最终导致管腔狭窄。套管组和吻合法均能安全有效地建立静脉置换模型,套管组总的手术时间及下腔静脉阻断时间较吻合法短,但术后模型成功率方面无明显差异。随着术后时间的延长,套管组管腔狭窄更为明显。因此吻合法构建的静脉置换模型更适用于静脉置换术后相关病理改变的研究。
猜你喜欢异体管壁合法合法兼职受保护公民与法治(2020年23期)2021-01-04被赖账讨薪要合法公民与法治(2020年3期)2020-05-30合法外衣下的多重阻挠中国外汇(2019年14期)2019-10-14释甲骨文“朕”字的一种异体写法汉字汉语研究(2019年2期)2019-08-27异体备查中国篆刻(2017年7期)2017-09-05异体备查中国篆刻(2017年8期)2017-09-05异体备查中国篆刻(2017年5期)2017-07-18非绝缘管壁电磁流量计的权重函数仿真分析计算机测量与控制(2017年6期)2017-07-01找个人来替我怀孕一一代孕该合法吗?妈妈宝宝(2017年2期)2017-02-21水辅助共注塑弯管壁厚的实验分析中国塑料(2016年12期)2016-06-15