赵 业,卜少阳,王 涵,崔 皓,郝志军,许润润,李诗浩,程亚秋,马 恬
(1.烟台大学海洋学院,山东 烟台264005;2.烟台海关技术中心,山东 烟台265699)
甜菜碱(Betaine)化学名为三甲基甘氨酸,系一种季胺型生物碱,广泛存在于动植物体内。甜菜碱含有三个有效的活性甲基,为动物机体内最重要的甲基供体[1],可参与蛋白质和脂肪代谢,具有促进生长、改善酮体组成等功效[2-4]。同时,甜菜碱具有两性两极离子特征,是植物、细菌、动物体内重要的渗透压调节剂,能提高机体细胞应对干旱、高温、高盐及高渗透压等不良环境的耐受性,有效调节组织渗透压和离子平衡,稳定生物酶活性。研究表明,哺乳动物在细胞低渗肿胀和高渗萎缩时会释放或累积甜菜碱以保持细胞体积稳定[5-6]。鱼类研究则表明,甜菜碱的存在可以使大西洋鲑(Atlanticsalmon)和欧鳟(Salvelinusconfluentus)改变肌肉水分含量从而适应所处水体盐度的变化,有利于其保持电解质和渗透压的平衡,提高成活率[7]。
生物体内的甜菜碱主要由甜菜碱高半胱氨酸甲基转移酶(Betaine homocysteine methyltransferase, BHMT)催化分解。BHMT是一种巯基甲基转移酶(含Zn2+),可催化甜菜碱和高半胱氨酸生成二甲基甘氨酸和甲硫氨酸,进而有效降低高半胱氨酸的浓度,而相关研究表明在高水平的高半胱氨酸浓度是诱导引发机体的心脑血管疾病的独立危险因素[8]。同时,由于BHMT催化后的高半胱氨酸再甲基化无特殊辅酶依赖性,且反应产物可促进甲硫氨酸合成酶甲基化途径的进行,因此对于有效实现机体甲硫氨酸的循环利用尤为重要[9]。目前,已有研究报道多种水生生物bhmt基因序列,且主要集中在鱼类中,如牙鲆(Paralichthysolivaceus)、鲈鱼(Lateolabraxjaponicus)、黄鲈(Percaflavescens)、金头鲷(Sparusaurata)、斑马鱼(Daniorerio)[10],而在海洋无脊椎动物中该基因报道较少。
刺参(Apostichopusjaponicus),位列“海八珍”之首,因其具有较高的营养和药用价值,目前已成为中国北方重要的海水养殖品种。刺参是狭盐性动物,研究表明盐度变化对刺参的存活生长、呼吸排泄、能量收支和免疫调控等均具有重要影响[11-14]。目前国内外对于刺参养殖多为近海池塘养殖且养殖区域多位于潮间带,养殖区池塘的海水盐度极易受到雨季、潮汐等气候因素从而发生急剧变化,因而盐度已成为对刺参养殖产业造成较大威胁甚至引发重大经济损失的重要因素。本实验主要利用RACE (Rapid-amplification of cDNA ends)技术克隆获取了刺参bhmt1基因的全长cDNA,分析了其序列结构特征;利用qRT-PCR技术分析了刺参bhmt1基因在组织中和不同低盐胁迫下的表达模式,为进一步探究bhmt1基因功能及揭示刺参应对盐度变化导致的渗透压调节机制提供数据支撑,以期丰富刺参的生理生态学理论。
1.1 实验材料与低盐胁迫实验
试验幼参于2021年3月5日购自山东安源科技有限公司,平均个体质量3.6±0.26 g,平均体长4.3±0.6 cm。胁迫实验前均用520 cm×700 cm×400 cm 的塑料牛筋箱暂养7 d(共4箱,每箱100头);养殖海水取自烟台近海,经沙滤沉淀除去杂质,pH为7.9±0.1,溶氧量为7.63 mg/L,水温18±1 ℃,盐度32,每次换水保证其曝气48 h以上,充氧泵连续充气;每日17:00全量更换海水,清理排泄物,并按体重2%比例投饵,保持自然光周期。选取健康刺参幼参进行解剖,分别取肠道、呼吸树、肌肉、体壁、体腔液等组织液氮速冻后于-80 ℃ 超低温冰箱中备用。
选取养殖于天然海水(其盐度为32,无低盐胁迫)的刺参视作对照组,选择盐度为16和24的海水用以胁迫养殖刺参作为低盐试验组。低盐胁迫的海水为自来水经曝气放置24 h后与天然海水按照比例混合从而配制成盐度分别为24和16的实验用水。将刺参幼参随机分为五组,分别放入天然海水、盐度为24和16的海水中进行试验(试验用520 cm×500 cm×400 cm 塑料牛津箱,天然海水1箱,盐度为24和16的各2箱,每箱放入刺参幼参60头),并分别在试验开始后0、24、48、72和96 h进行取样,每个时间点每组随机取10头幼参,分别取幼参肠道和呼吸树组织,并将样本保存于-80 ℃超低温冰箱中备用。
1.2 总RNA提取
采用液氮研磨组织并利用碧云天RNAeasyTM动物RNA抽提试剂盒提取刺参组织总RNA,通过琼脂糖电泳实验检测所提取的总RNA完整性、通过微量紫外分光光度计检测总RNA纯度并测定核酸浓度。提取合格的RNA置于-80 ℃冰箱保存备用。
1.3 全长cDNA克隆
根据前期刺参转录组数据库获得的bhmt1基因部分序列进行特异性引物设计(表1)[15],利用SMART RACE cDNA末端扩增试剂盒(Clontech, USA)对bhmt1基因分别进行3′cDNA和5′cDNA全长克隆PCR,按照试剂盒说明书进行PCR扩增反应。利用OMEGA公司的胶回收试剂盒回收获得胶块中的DNA,连接至载体pMD19-T vector上,并将连接产物转化到商品化感受态细胞JM109 (Takara, Japan)中,复苏1 h后涂在含氨苄的LB平板上过夜培养。挑取阳性克隆于SOC液体培养基中培养12~16 h。菌液PCR验证所获DNA条带大小后,送华大基因测序公司进行DNA序列测序[16]。

表1 引物序列
1.4 生物信息分析
利用DNAStar软件对所获得的序列进行拼接,获得完整bhmt1cDNA全长序列,并分析基因的开放阅读框和氨基酸组成。利用NCBI网站上的BLAST工具(http://www.ncbi.nlm.nih.gov/blast)对所获取的bhmt1cDNA序列和推导的氨基酸序列进行同源比对分析。利用 NetNGlyc1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/) 和NetPhos3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/) 查找糖基化位点和磷酸化位点。利用SMART version 4.0工具(http://www.smart.embl-heidelberg.de/)预测氨基酸序列的功能结构域,并用PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/) 和SWISS-MODEL(http:swissmodel.expasy.org/)预测蛋白质空间二级和三级结构。利用Clustal W程序和MEGA 5.0程序进行bhmt1基因的多序列比对和系统进化树构建。
1.5 bhmt1基因表达模式分析
采用 RT-qPCR 技术,用 CFX96 Real Time PCR System (Bio-Rad,美国) 检测刺参bhmt1基因在肠道、呼吸树、肌肉、体壁、体腔液组织中 mRNA水平的组织表达模式。以刺参组织RNA为材料(RNA提取方法同上),利用PrimeScript®RT Master Mix Perfect Real Time (Takara,Japan)试剂盒反转录出第一链cDNA,经适当稀释后作为qRT-PCR反应的模板。qRT-PCR反应以actin基因作为内参基因,bhmt1所用引物是在基因开放阅读框序列基础上设计(表1)。反应条件为:(1)95 ℃预变性5 s;(2)95 ℃变性10 s,60 ℃复性20 s,72 ℃延伸30 s,共40个循环;(3)添加溶解曲线,以检测扩增产物是否单一。每个反应设置三次重复,利用2-ΔΔCT算法计算基因的相对表达量。
1.6 低盐胁迫下bhmt1基因时空表达特征
利用qRT-PCR技术分析bhmt1基因在各低盐盐度试验处理组24 h、48 h、72 h和96 h胁迫后各组织(肠道和呼吸树)的表达水平,具体方法同1.5。每组样本量为4头,利用SPSS18.0软件进行单因素方差分析对照组和胁迫组组间的差异显著性,独立样本t检验分析盐度16与24组间基因表达差异,视P<0.05为有统计学意义。
2.1 刺参bhmt1基因的cDNA克隆及序列分析
刺参bhmt1基因cDNA全长为2328 bp,其中包含160 bp的5′UTR区域和917 bp的3′UTR区域。该基因的开放阅读框长度为1251 bp,161~163 bp处为起始密码子ATG,1409~1411 bp处为终止密码子TAA,共编码416个氨基酸。根据软件预测其蛋白质分子质量为45.95 kU,等电点为5.64(图1)。不含糖基化位点,含有8个磷酸化位点,分别为Y34、S64、S321、S326、S354、T385、S386、S405。利用SMART在线工具分析刺参bhmt1基因的功能结构域,结果表明该基因序列包括三个可能作为底物结合位点的锌指结构序列:(1)DGG(AA positions:22—24),(2)T(AA positions:41),(3)E(AA positions:155)。此外,分析表明在人bhmt1基因中发现的与Zn2+结合的3个半胱氨酸残基位点同样在刺参bhmt1基因存在(AA positions:213,295,296黄色圈标注),其中后2个半胱氨酸残基所在的基序结构GGCCGXXPXHI (AA positions 293~303绿色框标注)是依赖Zn2+的硫醇和硒醇甲基转移酶家族的典型结构。该基因全长cDNA序列已经提交NCBI网站,获得注册号为GenBank Accession No. MG734909。使用SWISSmodel 软件对BHMT1氨基酸序列进行二级结构和三维结构预测,结果表明BHMT1蛋白存在43.27% α 螺旋、 9.38% β 折叠、47.36%无规则卷曲结构(图2(a)),三维空间结构预测如图2(b)和图2(c)所示。

红色框标注为起始密码子和终止密码子,黄色圈标注为与Zn2+结合的半胱氨酸残基,绿色框标注为典型GGCCGXXPXHI基序结构。

2.2 序列同源性与系统进化树分析
将刺参蛋白BHMT1序列在NCBI中的Blast同源比对分析发现,其与非洲爪蟾Xenopuslaevis(NP-001088416.1)的BHMT1序列同源性相对较高,相似度为68.17%,与智人Homosapiens(NP-001704.2)、小鼠Musmusculus(NP-057877.1)、牙鲆Paralichthysolivaceus(ABM88795.1)、紫海胆Strongylocentrotuspurpuratus(XP-781040.1)囊舌虫Saccoglossuskowalevskii(XP-002737404.2)的BHMT1序列相似度分别为66.17%,66.50%,66.17%,66.67%,和66.08%(图3)。值得一提的是,上述物种中BHMT1序列均含有三个可能作为底物结合位点的锌指结构序列和Zn2+结合的3个半胱氨酸残基,说明上述位点保守性很强。

以刺参和从NCBI获得的其他物种BHMT1蛋白序列为基础,利用NJ(neighbor-joining)方法构建系统进化树。结果表明,进化树分为两大支,脊椎动物聚为一支,无脊椎动物中的紫海胆和囊舌虫单独聚为一支。刺参BHMT1介于两支之间,亲缘关系与脊椎动物相对更近,但相比其他脊椎物种同源关系较远(图4),刺参BHMT1的进化地位与刺参生物学分类地位基本一致。
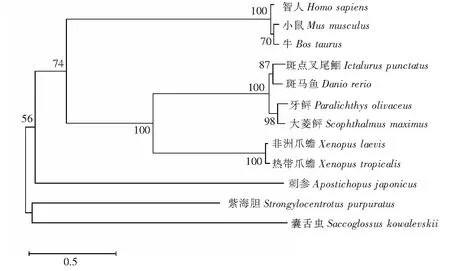
图4 刺参与其他物种BHMT1氨基酸序列进化树
2.3 bhmt1基因在刺参不同组织的表达分析
RT-qPCR 结果显示,刺参bhmt1在所检测的肠道、呼吸树、肌肉、体壁等组织中均有表达,且在呼吸树中表达水平最高,在肌肉、肠道、体壁中次之,在体腔液中几乎不表达(图5)。

图5 刺参bhmt1的组织表达模式
2.4 不同程度低盐胁迫对刺参肠道和呼吸树组织bhmt1基因表达的影响
刺参幼参受不同程度的低盐胁迫后bhmt1基因在两种组织的表达情况如图6所示。在盐度为16的低盐海水胁迫后各时间点,刺参bhmt1基因在两种组织中均出现了显著上调表达(P<0.05),且在呼吸树组织中差异上调表达倍数更高。在呼吸树组织内,低盐胁迫各时间点bhmt1基因表达量均极显著高于对照组(P<0.01),在胁迫24 h后基因表达量达到最大值,为对照组的91.74倍,之后表达量随胁迫时间延长逐渐下降;在肠道组织内,低盐胁迫24 h后bhmt1基因表达量显著高于对照组(P<0.05),且表达量随胁迫时间延长逐渐上升,在胁迫72 h后达到表达量最大值,为对照组的61.98倍,之后出现表达量下降。在盐度为24的低盐海水胁迫后各时间点内,bhmt1基因在两种组织中均出现了显著上调表达, 且两种组织中表达倍数基本相似。

图6 低盐胁迫后刺参幼参两种组织中bhmt1基因表达分析
胁迫24 h后,肠道和呼吸树中bhmt1基因出现显著上调表达(P< 0.05),在48 h和72 h经历短暂表达量回落后,在胁迫96 h时bhmt1基因表达量达到最大值且与对照组存在极显著差异(P<0.01),此时肠道中该基因表达量为对照组的67.43倍,呼吸树中该基因的表达量为对照组的84.68倍。此外,肠道组织中盐度为16处理下bhmt1基因表达量在48 h显著高于盐度为24的基因表达量(P<0.01),而在96 h显著低于盐度为24的基因表达量(P<0.01),且呼吸树组织中盐度为16处理下bhmt1基因表达量在24~72 h均显著高于盐度为24的基因表达量(P<0.01)。
BHMT1具有Zn2+依赖的硫醇和硒醇甲基转移酶家族的典型结构特征,即具有GGCCGXXPXHI的结构基序[10]。研究表明,该结构基序序列高度保守,含有的三个半胱氨酸可与Zn2+结合并激活高半胱氨酸,如果其中任何一个半胱氨酸发生突变都会导致BHMT无法与Zn2+结合而失去催化功能[17-18]。对刺参bhmt1基因cDNA序列分析表明,刺参BHMT1由416个氨基酸组成并含有BHMT的典型基序结构GGCCGFEPYHI,同时含有决定酶催化能力的与Zn2+结合的三个半胱氨酸(AA213、AA295和AA296)。此外,EVANS等发现的BHMT中可能作为甜菜碱结合位点的锌指结构序列同样在刺参BHMT1序列中完全保守(D22-G23-G24,T41和E155)[19],因此刺参BHMT1上述特征结构的保守性暗示着刺参BHMT1具有结合并催化同型半胱氨酸的能力。
在哺乳动物文献报道中,BHMT主要在肝肾组织中表达,其在肝脏组织中活性最高,表达量甚至占肝脏全部蛋白质的0.6%~1.6%[20-23]。同时,不同物种BHMT的组织表达特征存在一定差异,如BHMT在人和猪的肾脏组织中表达较低,在大鼠肾脏中几乎检测不到表达量,而在成年反刍动物的肝胰腺中和恒河猴(Macacamulatta)的晶体中BHMT则呈现高表达活性[24-25]。据文献报道,BHMT在日本石斑鱼(Lateolabraxjaponicas)和鲈鱼(L.japonicus)中主要在肝脏、消化道和肾脏组织中有表达[10]。本研究表明刺参bhmt1基因在呼吸树、肌肉、肠道和体壁四种组织中均有表达,且在呼吸树中表达量高于其他组织。这与其他文献报道有很大差异,可能与刺参独特的生理结构有关。目前文献尚未报道刺参存在专门的渗透调节器官,而FOGLIETTA 等的研究则指出海参呼吸树细胞遵守范托夫渗透法则,具有良好的渗透调节能力[26]。结合本研究结果,我们推测这种良好的渗透调节能力很有可能归因于bhmt1基因高表达催生的甜菜碱调控效果。
盐度是影响刺参生理代谢的最重要的环境因子之一,对其存活、生长、发育和免疫调节均有很大的影响[11]。作为典型的狭盐性动物,刺参的极限盐度生长范围为22~36,最适盐度生长范围为28~34,盐度过高或过低会引发刺参吐肠甚至死亡[11-12]。由于缺乏如硬骨鱼肾脏的特异渗透调节器官,刺参不能自主调节体腔液的渗透压,故其体腔液通常与周围环境保持等渗,因此外界盐度改变会引发刺参体腔液渗透压的改变[27]。研究表明BHMT可通过调控体内甜菜碱稳态发挥对机体渗透压变化的响应。如有关哺乳动物和鱼类的研究表明渗透压改变BHMT的表达,如猪在高渗条件下其肝脏、肾脏 BHMT表达降低[28];LU等则发现将香鱼(Plecoglossusaltivelis)从淡水转到海水后,其鳃中 BHMT 蛋白和 mRNA 均出现下调表达[29];钱云霞等研究则表明将鲈鱼转入低盐环境后,bhmt在肝、肠、肾组织中均出现显著上升表达[10]。本研究结果表明,两种低盐胁迫下,bhmt1基因在刺参肠道和呼吸树组织中均有显著上调,从而提高了甜菜碱的分解水平,而低浓度甜菜碱有助于机体对于低渗环境的适应,这表明bhmt1很可能在刺参盐度适应过程中的渗透压调节中发挥重要作用,其调控途径的激酶途径是否与脊椎动物相同则有待进一步实验加以验证。同时,相对于盐度24的低盐胁迫,我们发现在盐度为16的低盐胁迫中,bhmt1基因上调倍数更高,且这一趋势在呼吸树组织中更明显,暗示着bhmt1基因随着低盐程度加剧调控程度加深,且调控主要部位为呼吸树组织。值得一提的是,甜菜碱作为机体面对不适环境的渗透物,可实现对体内重要细胞、蛋白质和酶的保护[30],BHMT作为调节机体甜菜碱稳态的关键酶,在生物应对不良环境响应中很可能发挥重要作用,如前期研究中在刺参夏眠过程中同样发现了该基因在呼吸树组织的显著上调表达[15]。
综上所述,本研究克隆了刺参bhmt1基因的cDNA全长,实时定量PCR分析表明该基因在刺参各组织器官中具有一定程度表达,且在呼吸树中表达最高;在不同程度低盐胁迫时刺参呼吸树和肠道组织中bhmt1基因均出现显著上调表达,推测该基因参与了刺参盐度变化的渗透压适应过程,为探究bhmt1基因功能及探究刺参渗透压适应调节机制奠定了基础。
猜你喜欢甜菜碱刺参渗透压高考生物问答复习之渗透压求学·理科版(2022年4期)2022-04-03夏眠的刺参红蜻蜓·低年级(2021年12期)2022-01-19夏眠的刺参红蜻蜓·低年级(2021年12期)2021-12-193 种不同体色刺参体壁营养成分的比较研究*渔业科学进展(2021年3期)2021-05-12光照对白刺参、青刺参和紫刺参生长、消化及免疫的影响大连海洋大学学报(2020年2期)2020-05-06——2017年渗透压相关高考真题赏析">化基本概念为源头活水——2017年渗透压相关高考真题赏析教学考试(高考生物)(2017年5期)2017-12-13心搏骤停后综合征患者血浆渗透压测定的临床意义医学研究杂志(2015年6期)2015-07-01血浆渗透压和APACHEⅡ评分对心肺复苏后患者脑损伤的评估医学研究杂志(2015年12期)2015-06-10磺基甜菜碱的研究进展及在洗护用品中的应用中国洗涤用品工业(2015年8期)2015-02-28甜菜碱类两性离子共聚物涂层的构建及释药行为研究应用化工(2014年9期)2014-08-10